Книга: Общая химия
155. Диоксид углерода. Угольная кислота.
| <<< Назад 154. Химические свойства углерода. Карбиды. |
Вперед >>> 156. Оксид углерода (II). |
155. Диоксид углерода. Угольная кислота.
Диоксид углерода CO2 постоянно образуется в природе при окислении органических веществ (гниение растительных и животных остатков, дыхание, сжигание топлива). В больших количествах он выделяется из вулканических трещин и из вод минеральных источников.
В лабораториях диоксид углерода обычно получают, действуя на мрамор CaCO3 соляной кислотой в аппарате Киппа:
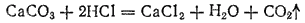
В промышленности большие количества диоксида углерода получают при обжиге известняка:
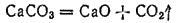
Диоксид углерода при обычных условиях — бесцветный газ, примерно в 1,5 раза тяжелее воздуха, благодаря чему его можно переливать, как жидкость, из одного сосуда в другой. Масса 1 л CO2 при нормальных условиях составляет 1,98 г. Растворимость диоксида углерода в воде невелика: 1 объем воды при 20°C растворяет 0,88 объема CO2, а при 0°C - 1.7 объема. Применяется диоксид углерода при получении соды по аммиачно-хлоридному способу (см. стр. 426), для синтеза карбамида (стр. 427), для получения солей угольной кислоты, а также для газирования фруктовых и минеральных вод и других напитков.
Под давлением около 0.6 МПа диоксид углерода при комнатной температуре превращается в жидкость. Жидкий диоксид углерода хранят в стальных баллонах. При быстром выливании его из баллона поглощается вследствие испарения так много теплоты, что CO2 превращается в твердую белую снегообразную массу, которая, не плавясь, сублимируется при -78,5°C. Твердый диоксид углерода под названием «сухой лед» применяется для охлаждения скоропортящихся продуктов, для производства и сохранения мороженого, а также во многих других случаях, когда требуется получение низкой температуры.
Раствор CO2 в воде имеет кисловатый вкус и обладает слабокислой реакцией, обусловленной присутствием в растворе небольших количеств угольной кислоты H2CO3, образующейся в результате обратимой реакции:
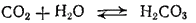
Таким образом, диоксид углерода является ангидридом угольной кислоты.
Равновесие последней реакции сильно сдвинуто влево лишь очень небольшое количество растворенного CO2 превращается в угольную кислоту.
Угольная кислота H2CO3 может существовать только в водном растворе. При нагревании раствора диоксид углерода улетучивается, равновесие образования H2CO3 смещается влево, и в конце концов остается чистая вода.
Угольная кислота очень слабая. В растворе она диссоциирует главным образом на ионы H+ и HCO3- и лишь в ничтожном количестве образует ионы CO32-:
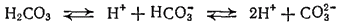
Константа диссоциации угольной кислоты по первой ступени, учитывающая равновесие ионов со всем количеством диоксида углерода в растворе (как в форме CO2, так и в виде угольной кислоты), выражается соотношением:
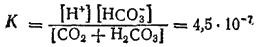
- 425 -
Константа диссоциации по второй ступени;
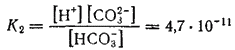
Как двухосновная кислота, угольная кислота образует два ряда солей — средние и кислые; средние соли называются карбонатами, кислые — гидрокарбонатами.
Соли угольной кислоты могут быть получены или действием диоксида углерода на щелочи, или путем обменных реакций между растворимыми солями угольной кислоты и солями других кислот. Например:
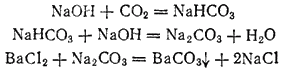
Со слабыми основаниями угольная кислота в большинстве случаев дает только основные соли, примером которых может служить карбонат гидроксомеди (CuOH)2 CO3 . Встречающийся в природе минерал такого состава называется малахитом.
При действии кислот, даже таких слабых, как уксусная, все карбонаты разлагаются с выделением диоксида углерода. Этой реакцией часто пользуются для открытия карбонатов, так как выделение CO2 легко обнаружить по характерному шипению.
При нагревании все карбонаты, кроме солей щелочных металлов, разлагаются с выделением CO2. Продуктами разложения в большинстве случаев являются оксиды соответствующих металлов, например:
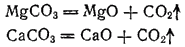
Гидрокарбонаты щелочных металлов при нагревании переходят в карбонаты:
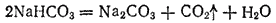
Большинство гидрокарбонатов, а также карбонаты калия, натрия, рубидия, цезия и аммония растворимы в воде; карбонаты других металлов в воде нерастворимы.
Растворы карбонатов щелочных металлов вследствие гидролиза имеют сильнощелочную реакцию
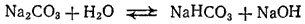
или
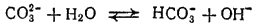
Из солей угольной кислоты в природе чрезвычайно распространен карбонат кальция CaCO3. Он встречается в виде известняка, мела, мрамора.
Карбонат кальция нерастворим в воде. Поэтому известковая вода (раствор гидроксида кальция) при пропускании через нее диоксида углерода мутнеет:
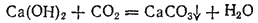
Однако, если пропускать CO2 через известковую воду долгое время, то мутная вначале жидкость постепенно светлеет и наконец становится совершенно прозрачной. Растворение происходит вследствие образования кислой соли — гидрокарбоната кальция:
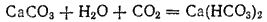
Гидрокарбонат кальция — вещество непрочное. При кипячении раствора или продолжительном его стоянии на воздухе гидрокарбонат разлагается с выделением CO2 и образованием средней соли.
Растворимостью гндрокарбонатов в воде объясняется постоянное передвижение карбонатов в природе. Почвенные и грунтовые воды, содержащие CO2, просачиваясь сквозь почву и особенно сквозь пласты известняка, растворяют карбонат кальция и уносят его с собой в виде гидрокарбоната в ручьи, реки и моря. Оттуда он попадает в организмы морских животных и идет на построение их скелетов или, выделяя диоксид углерода, снова превращается в карбонат кальция и отлагается в виде пластов.
Кроме карбоната кальция, в природе встречается в больших количествах карбонат магния MgCO3, известный под названием магнезита. Карбонат магния, как и карбонат кальция, легко растворяется в воде, содержащей CO2, переходя в растворимый гидрокарбонат.
Некоторые карбонаты являются ценными рудами и служат для получения металлов (например, шпатовый железняк FeCO3, галмей ZnCO3).
Карбонат натрия, или сода, Na2CO3. В виде кристаллогидрата сода отвечает формуле Na2CO3·H2O. Однако этот кристаллогидрат легко выветривается — теряет часть кристаллизационной воды.
Сода — один из главных продуктов основной химической промышленности. Она в больших количествах потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и другими отраслями промышленности, а также служит для получения различных солей натрия. Применяется сода и в быту, главным образом как моющее средство.
В настоящее время соду получают в промышленности аммиачно-хлоридным способом, основанным на образовании гидрокарбоната натрия при реакции между хлоридом натрия и гидрокарбонатом аммония в водном растворе.
Концентрированный раствор хлорида натрия насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известняка.
При взаимодействии аммиака, диоксида углерода и воды образуется гидрокарбонат аммония
NH3 + CO2 + H2O = NH4HCO3
который, вступая в обменную реакцию с хлоридом натрия, образует хлорид аммония и гидрокарбонат натрия:
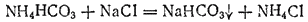
Гидрокарбонат натрия сравнительно мало растворим в холодной воде и выделяется в виде осадка, который отфильтровывают.
При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и диоксид углерода, вновь поступающий в производство:
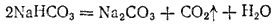
Нагревая раствор, содержащий хлорид аммония, с гашеной известью, выделяют аммиак
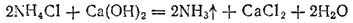
который также возвращается в производство.
Таким образом, единственным отходом производства является хлорид кальция, остающийся в растворе после выделения аммиака и имеющий ограниченное применение.
Полученный по аммначно-хлоридному способу карбонат натрия не содержит кристаллизационой воды и называется кальцинированной содой.
Часть гидрокарбоната натрия используется без дальнейшей переработки. Например, под названием питьевой, или двууглекислой, соды он применяется в медицине, в хлебопечении, в пищевой промышленности.
Производство кальцинированной соды в СССР непрерывно растет. В 1957 г. оно составило 1.6 млн. т, примерно втрое превысив объем производства 1940 г., а в 1985 г. достигло 503 млн. т.
Карбонат калия, или поташ, K2CO3 представляет собой белый порошок, расплывающийся во влажном воздухе и хорошо растворимый в воде. Применяется он для получения мыла, при изготовлении тугоплавкого стекла, в фотографии. Поташ получают действием диоксида углерода на раствор гидроксида калия, образующийся при электролизе раствора хлорида калия:
2KOH + CO2 = K2CO3 + H2O
Важное в практическом отношении соединение — карбамид, или мочевина, CO(NH2)2 получается взаимодействием диоксида углерода с аммиаком под давлением:
CO2 + 2NH3 = CO(NH2)2 + H2O
Этот способ получения карбамида был открыт в 1870 г., А. И. Базаровым.
- 428 -
Карбамид представляет собой белые кристаллы, хорошо растворимые в воде. Он используется в сельском хозяйстве в качестве высококонцентрированного азотного удобрения и как добавка к корму жвачных животных. На основе карбамида получают дешевые пластические массы, так называемые карбамидные пластики. Он служит также исходным материалом для получения многих органических веществ и лекарственных препаратов. Некоторые производные карбамида обладают гербицидными свойствами — они применяются для борьбы с сорняками.
| <<< Назад 154. Химические свойства углерода. Карбиды. |
Вперед >>> 156. Оксид углерода (II). |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- 156. Оксид углерода (II).
- Яблочная кислота полезна для здоровья
- 4. КАМЕННОУГОЛЬНАЯ СИСТЕМА СЛОЕВ
- 3.32. «ДРЕВЕСНАЯ КИСЛОТА». «КРИМИНАЛЬНОЕ» ПРОИСХОЖДЕНИЕ БЕНЗОЛЬНОГО КОЛЬЦА
- 3.28. КАК ПОЯВИЛОСЬ НАЗВАНИЕ «ЛИМОННАЯ КИСЛОТА»
- 3.30. ЕСТЬ ЛИ В ЯБЛОКАХ ЯБЛОЧНАЯ КИСЛОТА, А В ВИНЕ — ВИННАЯ?
- 5.2. ДИОКСИД УГЛЕРОДА В РОЛИ «НОСИЛЬЩИКА»
- 5.50. ЧТО ТАКОЕ КРАСНАЯ АЗОТНАЯ КИСЛОТА?
- 6.52. ОПАСНАЯ КИСЛОТА
- 5.13. ЧЕМ ДЫМИТ «ДЫМЯЩАЯ СЕРНАЯ КИСЛОТА»?
- 5.60. МОЖЕТ ЛИ КИСЛОТА ГОРЕТЬ?
- 9.45. МЕЛЛИТОВАЯ КИСЛОТА
