Книга: Общая химия
171. Альдегиды и кетоны.
| <<< Назад 170. Простые эфиры. |
Вперед >>> 172. Карбоновые кислоты. |
171. Альдегиды и кетоны.
В молекулах этих соединений содержится двухвалентная карбонильная группа
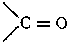
- 469 -
Наличие и в альдегидах, и в кетонах карбонильной группы обусловливает определенное сходство их свойств. Однако имеются и различия, связанные с тем, что в молекулах альдегидов одна из связей карбонильной группы затрачивается на соединение с водородом; поэтому они содержат своеобразную альдегидную функциональную группу
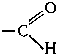
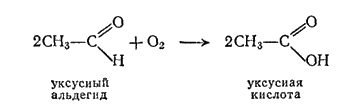
Вследствие легкой окисляемости альдегиды являются энергичными восстановителями; этим они существенно отличаются от кетонов, которые окисляются значительно труднее. Например, альдегиды восстанавливают оксид серебра (I) до металлического серебра (реакция серебряного зеркала — серебро осаждается на стенках сосуда, образуя зеркальный налет) и оксид меди(II) до оксида меди(I):
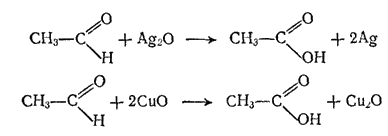
Кетоны в этих условиях не окисляются, поэтому обе реакции используют как качественные, позволяющие отличить альдегиды от кетонов.
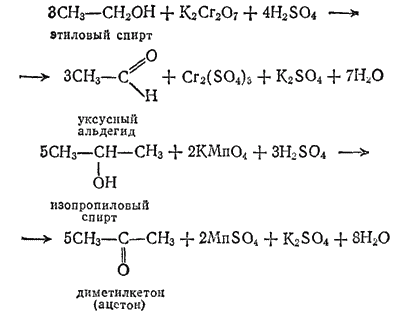
Альдегиды и кетоны можно получать окислением соответствующих спиртов, т. е. имеющих такой же углеродный скелет и гидроксильную группу при том же атоме углерода, который в получаемом альдегиде или кетоне образует карбонильную группу.
- 470 -
Например:
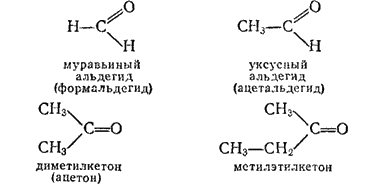
Муравьиный альдегид, или формальдегид, CH2=O — газ с резким неприятным запахом, хорошо растворим в воде. Обладает антисептическими, а также дубящими свойствами. Водный раствор формальдегида (обычно 40%) называется формалином; он широко применяется для дезинфекции, консервирования анатомических препаратов, протравливания семян перед посевом и т. п. Значительные количества формальдегида используются для получения фенолоформальдегидных смол (см. § 177). Получают формальдегид из метилового спирта путем каталитического окисления его кислородом воздуха или путем дегидрирования (отщеплеиия водорода);
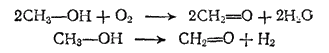
Эти реакции протекают при пропускании паров метилового спирта (в первом случае — в смеси с воздухом) над нагретыми катализаторами.
Уксусный альдегид, или ацетальдегид, CH3-CH=O. Легко кипящая бесцветная жидкость (темп. кип. 21°C), с характерным запахом прелых яблок, хорошо растворима в воде. В промышленности получается присоединением воды к ацетилену в присутствии солей ртути(II) в качестве катализатора;
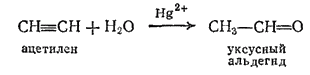
- 471 -
Эта реакция, имеющая большое практическое значение, была открыта М. Г. Кучеровым (1850—1911). Уксусный альдегид затем может быть окислен в уксусную кислоту; его используют и для многих других синтезов.
Ацетон, или диметилкетон, CH3-CH-CH3. Бесцветная жидкость с характерным запахом (темп. кип. 56,2°C); смешивается с водой во всех соотношениях. Очень хороший растворитель многих органических веществ. Широко применяется в лакокрасочной промышленности, в производстве некоторых видов искусственного волокна, небьющегося органического стекла, кинопленки, бездымного пороха, для растворения ацетилена (в баллонах).
Ацетон используется также как исходное вещество для синтеза ряда органических соединений.
| <<< Назад 170. Простые эфиры. |
Вперед >>> 172. Карбоновые кислоты. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
- Углеродный шовинизм
- «Шепот» звезд
- Клестовик
- 4.6.4. Сравнительная характеристика представителей типа Плоские черви
- НАВОЗНИКИ ГЕОТРУПЫ
- К истокам Кочурлы
- 2.2. Клетка – единица строения, жизнедеятельности, роста и развития организмов. Многообразие клеток. Сравнительная харак...
- Секретный рецепт
- «Бездонный» бокал
- 706. Какой экологический вред наносят морские миноги?
- ПОИСК ЭКСПЕРИМЕНТАЛЬНЫХ ДОКАЗАТЕЛЬСТВ
