Книга: Общая химия
154. Химические свойства углерода. Карбиды.
| <<< Назад 153. Аллотропия углерода. |
Вперед >>> 155. Диоксид углерода. Угольная кислота. |
154. Химические свойства углерода. Карбиды.
При низких температурах и уголь, и графит и, в особенности, алмаз инертны. При нагревании их активность увеличивается: уголь легко соединяется с кислородом и служит хорошим восстановителем. Важнейший процесс металлургии — выплавка металлов из руд — осуществляется путем восстановления оксидов металлов углем (или монооксидом углерода).
С кислородом углерод образует диоксид (или двуокись) углерода CO2, часто называемый также углекислым газом, и оксид углерода(II), или монооксид углерода, СО.
При очень высоких температурах углерод соединяется с водородом, серой, кремнием, бором и многими металлами; уголь вступает в реакции легче, чем графит и тем более алмаз.
Соединения углерода с металлами и другими элементами, которые по отношению к углероду являются электроположительными, называются карбидами. Их получают прокаливанием металлов или их оксидов с углем.
Карбиды — кристаллические тела. Природа химической связи в них может быть различной. Так, многие карбиды металлов главных подгрупп I, II и III групп периодической системы представляют собой солеобразные соединения с преобладанием ионной связи. К их числу относятся карбиды алюминия Al4C3 и кальция CaC2. Первый из них можно рассматривать как продукт замещения водорода на металл в метане CH4, а второй — в ацетилене C2H2. Действительно, при взаимодействии карбида алюминия с водой образуется метан
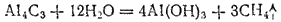
а при взаимодействии с водой карбида кальция — ацетилен:
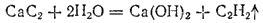
В карбидах кремния SiC (см. § 178) и бора B4C связь между атомами ковалентная. Эти вещества характеризуются высокой твердостью, тугоплавкостью, химической инертностью.
Большинство металлоз побочных подгрупп IV—VIII групп периодической системы образуют карбиды, связь в которых близка к металлической (см. § 190), вследствие чего эти карбиды в некоторых отношениях сходны с металлами, например обладают значительной электрической проводимостью. Они характеризуются также высокой твердостью и тугоплавкостью; карбиды этой группы применяются в ряде отраслей промышленности.
Большинство ценных свойств чугунов и сталей обусловлены присутствием в них карбида железа Fe3C (см. § 238).
| <<< Назад 153. Аллотропия углерода. |
Вперед >>> 155. Диоксид углерода. Угольная кислота. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- 155. Диоксид углерода. Угольная кислота.
- Химические элементы и вещества
- § 50 Химические реакции
- 427. Какие химические элементы содержатся в морской воде в наибольших количествах?
- Глава 8 Биогенная миграция химических элементов и биогеохимические принципы
- 682. Как химические питательные вещества преобразуются в пищу?
- 8.2. Биогеохимические принципы
- 909. Каковы основные химические загрязнители?
- 429. Как различные химические элементы попали в морскую воду?
- § 14. Химические явления. Горение
- 182. Каковы важнейшие физико-химические свойства воды?
- Глава 7 Биогеохимические процессы и продукционные циклы
