Книга: Общая химия
153. Аллотропия углерода.
| <<< Назад 152. Углерод в природе. |
Вперед >>> 154. Химические свойства углерода. Карбиды. |
153. Аллотропия углерода.
В свободном состоянии углерод известен в виде алмаза, кристаллизующегося в кубической системе, и графита, принадлежащего к гексагональной системе. Такие формы его, как древесный уголь, кокс, сажа, имеют неупорядоченную структуру.
- 419 -
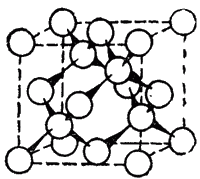
Рис. 117. Структура алмаза. Стрелки показывают связи между атомами в тетраэдрах.
Синтетически получены карбин и поликумулен — разновидности углерода, состоящие из линейных цепных полимеров типа ... -C?C-C?C... или ...=C=C=C=... Карбин обладает полупроводниковыми свойствами. При сильном нагревании без доступа воздуха он превращается в графит.
Алмаз — бесцветное, прозрачное вещество, чрезвычайно сильно преломляющее лучи света. Он кристаллизуется в кубической гранецентрированной решетке. При этом одна половина атомов располагается в вершинах и центрах граней одного куба, а другая — в вершинах и центрах граней другого куба, смещенного относительно первого в направлении его пространственной диагонали. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации и образуют трехмерную тетраэдрическую сетку, в которой они связаны друг с другом ковалентными связями*. Расстояние между атомами в тетраэдрах равно 0.154 нм. Структура алмаза показана На рис. 117.
* Подобное тетраэдрическое расположение связей, образуемых атомом углерода, характерно также для передельных углеводородов и их производных (см. § 162).
Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объема, — атомы углерода «упакованы» в алмазе очень плотно. С этим, а также с большой прочностью связи в углеродных тетраэдрах связано то, что по твердости алмаз превосходит все известные вещества. Поэтому его широко применяют в промышленности; почти 80% добываемых алмазов используются для технических целей. Его используют для обработки различных твердых материалов, для бурения горных пород. Будучи весьма твердым, алмаз в то же время хрупок. Получающийся при измельчении алмаза порошок служит для шлифовки драгоценных камней и самих алмазов. Должным образом отшлифованные прозрачные алмазы называются бриллиантами.
Ввиду большой ценности алмазов было предпринято много попыток получить их искусственным путем из графита. Однако долгое время эти попытки кончались неудачей. Только в 1955 г., применив очень высокое давление (порядка 1010 Па) и длительный нагрев при температуре около 3000°C, американским, а одновременно и шведским ученым удалось получить синтетические алмазы. В Советском Союзе также разработан метод получения синтетических алмазов, а в 1961 г. начато их промышленное производство. Кроме того, в 1969 г. в СССР синтезированы нитевидные кристаллы алмаза, причем их получают при обычном давлении.
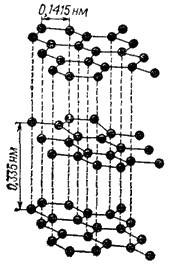
Рис. 118. Структура графита.
Нитевидные кристаллы, или "усы", имеют структуру, практически лишенную дефектов, и обладают очень высокой прочностью.
При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода. Если сильно нагреть алмаз без доступа воздуха, то он превращается в графит.
Графит представляет собой темно-серые кристаллы со слабым металлическим блеском. Он имеет слоистую решетку. Все атомы углерода находятся здесь в состоянии sp2-гибридизации: каждый из них образует три ковалентные ?-связи с соседними атомами, причем углы между направлениями связей равны 120°C. В результате возникает плоская сетка, составленная из правильных шестиугольников, в вершинах которых находятся ядра атомов углерода; расстояние между соседними ядрами составляет 0,1415 нм.
В образовании ?-связей участвуют три электрона каждого атома углерода. Четвертый электрон внешнего слоя занимает 2p-орбиталь, не участвующую в гибридизации. Такие негибридные электронные облака атомов углерода ориентированы перпендикулярно плоскости слоя и, перекрываясь друг с другом, образуют делокализованные ?-связи. Структура графита показана на рис. 118.
Соседние слои атомов углерода в кристалле графита находятся на довольно большом расстоянии друг от друга (0,335 нм); это указывает на малую прочность связи между атомами углерода, расположенными в разных слоях. Соседние слои связаны между собой в основном силами Ван-дер-Ваальса, но частично связь имеет металлический характер, т. е. обусловлена «обобществлением» электронов всеми атомами кристалла. Этим объясняется сравнительно высокая электрическая проводимость и теплопроводность графита не только в направлении слоев, но и в перпендикулярном к ним направлении.
Рассмотренная структура графита обусловливает сильную анизотропию его свойств. Так, теплопроводность графита в направлении плоскости слоев равна 4.0 Дж/(см·с·К), а в перпендикулярном направлении составляет 0,79 Дж/(см·с·К). Электрическое сопротивление графита в направлении слоев в 104 раз меньше, чем в перпендикулярном направлении.
Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
Этим объясняется малая механическая прочность графита. Если провести куском графита по бумаге, то мельчайшие кристаллики графита, имеющие вид чешуек, прилипают к бумаге, оставляя на ней серую черту. На этом основано применение графита для изготовления карандашей.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде, превращаясь в диоксид углерода.
Благодаря электрической проводимости графит применяется для изготовления электродов. Из смеси графита с глиной делают огнеупорные тигли для плавления металлов. Смешанный с маслом графит служит прекрасным смазочным средством, так как чешуйки его, заполняя неровности материала, создают гладкую поверхность, облегчающую скольжение. Графит применяют также в качестве замедлителя нейтронов в ядерных реакторах.
Кроме природного, в промышленности находит применение искусственный графит. Его получают главным образом из лучших сортов каменного угля. Превращение происходит при температурах около 3000°C в электрических печах без доступа воздуха. На основе естественного и, особенно, искусственного графита изготовляют материалы, применяемые в химической промышленности. Благодаря их высокой химической стойкости они используются для футеровки, изготовления труб и др.
Графит термодинамически устойчив в широком интервале температур и давлений, в частности при обычных условиях. В связи с этим при расчетах термодинамических величин в качестве стандартного состояния углерода принимается графит. Алмаз термодинамически устойчив лишь при высоких давлениях (выше 109 Па). Однако скорость превращения алмаза в графит становится заметной лишь при температурах выше 1000°C при 1750°C превращение алмаза в графит происходит быстро.
«Аморфный» углерод (уголь). При нагревании углеродсодержащих соединений без доступа воздуха из них выделяется черная масса, называемая «аморфным» углеродом или просто углем. Такой углерод состоит из мельчайших кристалликов с разупорядоченной структурой графита. Уголь растворяется во многих расплавленных металлах, например в железе, никеле, платине. Плотность угля колеблется от 1,8 до 2,1 г/см3.
Угли существенно различаются по своим свойствам в зависимости от вещества, из которого они получены и способа получения. Кроме того, они всегда содержат примеси, сильно влияющие на их свойства. Важнейшие технические сорта угля: кокс, древесный уголь, костяной уголь и сажа.
Кокс получается при сухой перегонке каменного угля. Применяется он главным образом в металлургии при выплавке металлов из руд.
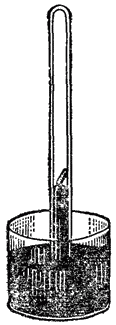
Рис. 119. Прибор для демонстрации поглощения аммиака углем.
Древесный уголь получается при нагревании дерева без доступа воздуха. При этом улавливают ценные продукты сухой перегонки — метиловый спирт, уксусную кислоту и др. Древесный уголь применяется в металлургической промышленности, в кузнечном деле.
Благодаря пористому строению, древесный уголь обладает высокой адсорбционной способностью.
Чтобы наблюдать адсорбцию газов углем, произведем следующий опыт. Наполним аммиаком стеклянный цилиндр и опустим открытый конец его в чашку с ртутью (рис. 119). Затем, прокалив на горелке кусочек древесного угля, погрузим его в ртуть и подведем под отверстие цилиндра с аммиаком. Уголь всплывает на поверхность ртути в цилиндре, и ртуть сейчас же начинает подниматься вверх вследствие поглощения аммиака углем.
Особенно хорошо поглощают газы активные угли (стр. 312). Они применяются для поглощения паров летучих жидкостей из воздуха и газовых смесей, в противогазах, а также в качестве катализатора в некоторых химических производствах.
Уголь обладает способностью адсорбировать не только газы, но и растворенные вещества. Это его свойство открыл в конце XVIII века русский академик Т. Е. Ловиц.
Костяной уголь получается путем обугливания обезжиренных костей. Он содержит от 7 до 11% углерода, около 80% фосфата кальция и другие соли. Костяной уголь отличается очень большой поглотительной способностью, особенно по отношению к органическим красителям, и служит для удаления из растворов различных красящих веществ.
Сажа представляет собой наиболее чистый «аморфный» углерод. В промышленности ее получают термическим разложением метана, а также сжиганием при недостаточном доступе воздуха смолы, скипидара и других богатых углеродом веществ. Сажа применяется в качестве черной краски (тушь, типографская краска), а также в производстве резины как ее составная часть.
| <<< Назад 152. Углерод в природе. |
Вперед >>> 154. Химические свойства углерода. Карбиды. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- 154. Химические свойства углерода. Карбиды.
- 189. Свинцовый аккумулятор.
- 163. Классификация органических соединений.
- 186. Германий (Germanium).
- 175. Амины.
- 168. Галогенпроизводные углеводородов.
- 152. Углерод в природе.
- 176. Аминокислоты и белки.
- 159. Газообразное топливо.
- 161. Отличительные особенности органических соединений.
- 160. Общая характеристика органических соединений.
- 184. Цемент.
