Книга: Общая химия
188. Свинец (Plumbum).
| <<< Назад 187. Олово (Stannuin). |
Вперед >>> 189. Свинцовый аккумулятор. |
Разделы на этой странице:
188. Свинец (Plumbum).
Содержание свинца в земной коре составляет 0,0016% (масс.). Наиболее важная руда, из которой добывается свинец, — свинцовый блеск PbS.
Первая металлургическая операция при получении свинца — это обжиг, в ходе которого сульфид свинца превращается в оксид:
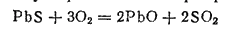
Получающийся оксид свинца (II) подвергают плавке в смеси с коксом, в результате чего получают черновой свинец, который содержит примеси многих металлов и подвергается последующей очистке.
Свинец — голубовато-белый тяжелый металл. Он очень мягок и режется ножом.
Свинец широко используется в технике. Наибольшее его количество расходуется на изготовление оболочек кабелей и пластин аккумуляторов. На сернокислотных заводах из свинца изготовляют кожухи башен, змеевики холодильников и другие ответственные части аппаратуры. Свинец идет на изготовление боеприпасов и на выделку дроби. Он входит в состав многих сплавов, например сплавов для подшипников, типографского металла (гарта), припоев. Свинец хорошо поглощает у-излучение и используется для защиты от него при работе с радиоактивными веществами.
Некоторое количество свинца расходуется на производство тетраэтилсвинца (см. стр. 455).
На воздухе свинец быстро покрывается тонким слоем оксида, защищающего его от дальнейшего окисления. Вода сама по себе не взаимодействует со свинцом, но в присутствии воздуха свинец постепенно разрушается водой с образованием гидроксида свинца (II):
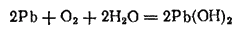
Однако при соприкосновении с жесткой водой свинец покрывается защитной пленкой нерастворимых солей (главным образом сульфата и основного карбоната свинца), препятствующей дальнейшему действию воды и образованию гидроксида.
Разбавленные соляная и серная кислоты почти не действуют на свинец. Это связано со значительным перенапряжением выделения водорода на свинце, а также с малой растворимостью хлорида и сульфата свинца, закрывающих поверхность растворяющегося металла. В концентрированной серной кислоте, особенно при нагревании, свинец интенсивно растворяется с образованием растворимой кислой соли Pb(HSO4)2.
- 510 -
В азотной кислоте свинец растворяется легко, причем в кислоте невысокой концентрации быстрее, чем в концентрированной. Это объясняется тем, что растворимость продукта коррозии — нитрата свинца — падает с увеличением концентрации кислоты. Сравнительно легко свинец растворяется в уксусной кислоте, содержащей растворенный кислород.
В щелочах свинец также растворяется, хотя и с небольшой скоростью; более интенсивно растворение идет в горячих разбавленных растворах. В результате растворения образуются гидроксоплюмбиты, например:
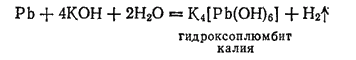
Все растворимые соединения свинца ядовиты.
Для свинца характерны степени окисленности +2 и +4. Значительно более устойчивы и многочисленны соединения со степенью окисленности свинца +2.
Соединения свинца(II).
Оксид свинца(II), или окись свинца, РbО — желтый порошок, образующийся при нагревании расплавленного свинца на воздухе. После прокаливания примерно при 500°C он приобретает красновато-желтый цвет и в таком виде называется глётом. Оксид свинца служит для заполнения ячеек в аккумуляторных пластинах, применяется при выработке некоторых сортов стекла; из него получают также другие соединения свинца.
Гидроксид свинца(II) Pb(OH)2 образуется при действии щелочей на растворимые соли свинца (II). Он обладает амфотерными свойствами и растворяется в кислотах с образованием солей свинца (II), а в щелочах с образованием гидроксоплюмбитов, например:
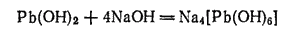
При сплавлении Pb(OH)2 с сухими щелочами получаются соли, называемые плюмбитами:
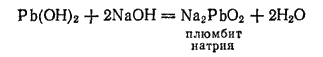
Хлорид свинца(II) PbCl2 получается в виде белого осадка при действии на растворы солей свинца (II) соляной кислотой или растворимыми хлоридами. Хлорид свинца мало растворим в холодной воде, но при повышении температуры его растворимость в воде сильно возрастает.
Иодид свинца(II) PbI2 выпадает в виде желтого осадка из растворов солей свинца (II) при введении в них иодид-ионов. В холодной воде он практически нерастворим, но хорошо растворяется в горячей, образуя бесцветный раствор.
- 511 -
При охлаждении последнего иодид свинца выделяется в виде золотисто-желтых кристаллов.
Ацетат свинца(II) Pb(CH3COO)2 — одна из немногих хорошо растворимых солей свинца, широко применяется в лабораторной практике. Ацетат свинца имеет сладкий вкус и называется также свинцовым сахаром. Он применяется при крашении тканей и для получения других соединений свинца.
Сульфат свинца(II) PbSO4 выпадает в виде белого осадка при прибавлении серной кислоты или растворимых сульфатов к растворам солей свинца(II). В воде и в разбавленных кислотах сульфат свинца почти нерастворим, но довольно легко растворяется в концентрированных растворах щелочей с образованием плюмбитов. Концентрированная серная кислота также растворяет сульфат свинца, превращая его в кислую соль Pb(HSO4)2.
Сульфид свинца(II) PbS образуется в виде черного осадка при действии сероводорода на соли свинца(II). Поэтому бумажка, смоченная раствором соли свинца (II), быстро темнеет, если в воздухе присутствуют даже незначительные количества сероводорода; этим пользуются для обнаружения H2S.
Для солей свинца(II), в отличие от солей олова (II), восстановительные свойства не характерны; перевести соединения свинца (II) в соединения свинца (IV) можно лишь с помощью очень сильных окислителей.
Соединения свинца(IV).
Диоксид (или двуокись) свинца PbO2 — темно-бурый порошок, образующийся при действии сильных окислителей на оксид или соли свинца (II). Диоксид свинца, подобно диоксиду олова, представляет собой амфотерный оксид с преобладанием кислотных свойств. Соли, отвечающие несуществующей в свободном состоянии свинцовой кислоте H2PbO3, называются плюмбатами. Например, при сплавлении диоксида свинца с оксидом кальция образуется плюмбат кальция CaPbO3:
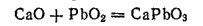
Большинство плюмбатов нерастворимо в воде. Растворимы плюмбаты натрия и калия; в растворе они сильно гидролизованы.
Основные свойства диоксида свинца проявляются в образовании очень нестойких солей свинца (IV). Так, при действии на диоксид свинца соляной кислоты в первый момент образуется хлорид свинца(IV) PbCl4, который, однако, легко отщепляет хлор, переходя в хлорид свинца (II) PbCl2:

Все соединения свинца (IV) — очень сильные окислители. Практическое применение в качестве окислителя в химической промышленности имеет PbO2.
- 512 -
Известны два смешанных оксида свинца: Pb3O4 и Pb2O3. Их можно рассматривать как соединения оксидов свинца(II) и (IV): 2PbO·PbO2(Pb3O4) и 2PbO·PbO2(Pb2O3). Сурик Pb3O4 — вещество ярко-красного цвета. На его основе изготовляют краску, применяемую для защиты металлов от коррозии,
| <<< Назад 187. Олово (Stannuin). |
Вперед >>> 189. Свинцовый аккумулятор. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- 189. Свинцовый аккумулятор.
- 186. Германий (Germanium).
- 168. Галогенпроизводные углеводородов.
- 176. Аминокислоты и белки.
- 160. Общая характеристика органических соединений.
- 180. Диоксид кремния.
- 166. Предельные циклические углеводороды.
- 170. Простые эфиры.
- 187. Олово (Stannuin).
- 185. Кремнийорганические соединения.
- 179. Соединения кремния с водородом и галогенами.
