Книга: Общая химия
182. Стекло.
| <<< Назад 181. Кремниевые кислоты и их соли. |
Вперед >>> 183. Керамика. |
182. Стекло.
При нагревании смесей многих силикатов с другими силикатами или с диоксидом кремния получаются прозрачные аморфные сплавы, называемые стеклами.
По структуре стекла представляют собой переохлажденные системы. Катионы и анионы вещества стекла расположены друг относительно друга как в жидкости, т. е. с соблюдением лишь ближнего порядка (см. § 53). В то же время тип движения ионов в стеклах — а основном колебания — характерен для твердого состояния. Такое строение находит отражение в том, что в отличие от веществ, находящихся в кристаллическом состоянии, стекла не имеют четких температур плавления и затвердевания. При нагревании стекло размягчается, постепенно переходя в жидкое состояние. При охлаждении расплавленного стекла затвердевание тоже происходит постепенно.
- 499 -
Стекло известно человеку с древних времен. Но на протяжении многих столетий им пользовались только для изготовления оконных стекол и посуды. В настоящее время получают стекла с разнообразными свойствами и используют их в различных целях. Для получения стекол с определенными свойствами пользуются разными исходными материалами. Кроме того, свойства стекол зависят от технологического процесса их изготовления.
Обычное оконное стекло, а также стекло, из которого приготовляется большая часть стеклянной посуды (бутылки, стаканы и т. п.), состоит главным образом из силикатов натрия и кальция, Сплавленных с диоксидом кремния. Состав такого стекла приблизительно выражается формулой Na2O·CaO·6SiO2. Исходными материалами для его получения служат белый песок, сода и известняк или мел. При сплавлении смеси этих веществ происходят следующие реакции:
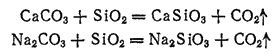
Часто соду заменяют сульфатом натрия Na2SO4 и углем. Уголь восстанавливает сульфат натрия в сульфит натрия Na2SO3, который, вступая в реакцию с песком, образует силикат натрия:
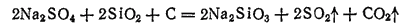
Если при варке стекла заменить соду поташом, то получается тугоплавкое стекло. Оно применяется для изготовления посуды, способной выдерживать сильное нагревание.
При сплавлении диоксида кремния с поташом и оксидом свинца получается тяжелое стекло, называемое хрусталем и содержащее силикаты калия и свинца. Такое стекло обладает большой лучепреломляющей способностью при шлифовании приобретает сильный блеск; из него делают оптические стекла и художественную посуду.
Большое влияние на свойства стекла оказывает замена части SiO2 борным ангидридом B2O3. Прибавление борного ангидрида увеличивает твердость стекла, делает его более стойким к химическим воздействиям и менее чувствительным к резким изменениям температуры. Из такого стекла изготовляется высококачественная химическая посуда.
Стекло обычно причисляют к веществам, нерастворимым в воде. Однако при продолжительном действии воды на обычное стекло вода отчасти извлекает из него силикат натрия. Если, например, взболтать истертое в порошок стекло с водой и затем прибавить несколько капель фенолфталеина, то жидкость окрашивается в розовый цвет, обнаруживая щелочную реакцию (вследствие гидролиза Na2SiO3).
Кроме перечисленных видов стекла, большое значение имеет стекло, приготовленное непосредственно из расплавленного в электрической печи кварца.
Кварцевое стекло можно подвергать действию более высоких температур, чем обычное. Оно пропускает ультрафиолетовые лучи, которые обычное стекло задерживает.
- 500 -
Очень ценным качеством кварцевого стекла является то, что коэффициент его термического расширения весьма мал. Это значит, что при нагревании или охлаждении объем кварцевого стекла почти не изменяется. Поэтому сделанные из него предметы можно сильно накалить и затем опустить а холодную воду: они не растрескиваются.
Кварцевое стекло применяется для изготовления лабораторной посуды и в химической промышленности. Оно используется также для изготовления электрических ртутных ламп, свет которых содержит много ультрафиолетовых лучей. Ртутные лампы применяют в медицине, для научных целей и при киносъемках. К недостаткам кварцевого стекла относятся трудность его обработки и хрупкость.
Вытягиванием расплавленного стекла через мелкие отверстия (фильеры) можно получать нити диаметром от 2 до 10 мкм — так называемое стеклянное волокно. Оно не хрупко и имеет очень большую прочность на разрыв. Ткани из этого волокна негорючи, обладают тепло-, электро- и звукоизолирующими свойствами, химически стойки.
Ценные свойства получаемых из стеклянного волокна материалов позволяют широко использовать их в различных областях техники. Большое значение при этом имеет доступность и дешевизна основного сырья и сравнительная простота производства стеклянного волокна.
Путем сочетания стеклянного волокна с различными синтетическими смолами получают новые конструкционные материалы — стеклопластики. Они в 3—4 раза легче стали, но не уступают ей по прочности, что позволяет с успехом заменять ими как металл, так и дерево. Из стеклопластиков, например, изготовляют трубы, выдерживающие большое гидравлическое давление и не подвергающиеся коррозии. Стеклопластики находят все большее применение в автомобильной, авиационной, судостроительной промышленности.
Стеклообразное состояние вещества термодинамически неустойчиво. Стекла существуют лишь благодаря тому, что при охлаждении расплавленного стекла его вязкость возрастает очень быстро, так что кристаллизация не успевает произойти. Вводя в исходные вещества добавки, ускоряющие кристаллизацию, и проводя варку по определенному режиму, можно получать стеклокристаллические материалы — ситаллы.
По своей структуре ситаллы представляют собой мелкие кристаллы, спаянные пленками незакристаллизовавшегося стекла. Они обладают высокой прочностью, твердостью, химической и термической стойкостью. По электрическим свойствам ситаллы относятся к изоляторам. Из ситаллов можно изготовлять дешевые и прочные строительные материалы, электроизоляторы, радиодетали, аппаратуру для химических производств.
| <<< Назад 181. Кремниевые кислоты и их соли. |
Вперед >>> 183. Керамика. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- «Шепот» звезд
- Клестовик
- 4.6.4. Сравнительная характеристика представителей типа Плоские черви
- НАВОЗНИКИ ГЕОТРУПЫ
- К истокам Кочурлы
- 2.2. Клетка – единица строения, жизнедеятельности, роста и развития организмов. Многообразие клеток. Сравнительная харак...
- Секретный рецепт
- «Бездонный» бокал
- 706. Какой экологический вред наносят морские миноги?
- ПОИСК ЭКСПЕРИМЕНТАЛЬНЫХ ДОКАЗАТЕЛЬСТВ
- Почему стемнело только к полуночи и ненадолго? Разве там нет ночи?
- Путешествовать помогает ветер
