Книга: Общая химия
156. Оксид углерода (II).
| <<< Назад 155. Диоксид углерода. Угольная кислота. |
Вперед >>> 157. Соединения углерода с серой и азотом. |
156. Оксид углерода (II).
Оксид углерода(II), или монооксид углерода, СО — бесцветный ядовитый газ, конденсирующийся в жидкость только при -192°C и затвердевающий при -205°C. В воде оксид углерода растворим очень мало и не вступает с ней в химическое взаимодействие.
Электронное строение молекулы СО рассмотрено на стр. 143. Как показано на рис. 53, шесть валентных электронов атомов углерода и кислорода размещаются на трех связывающих МО, образуя тройную связь; эта связь характеризуется высокой прочностью (1076 кДж/моль).
Образование тройной связи в молекуле СО можно объяснить и методом ВС. За счет двух неспаренных электронов, имеющихся в каждом из взаимодействующих атомов

возникают две ковалентные связи:
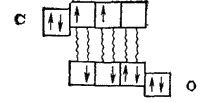
Как показывает эта схема, одна из орбиталей внешнего электронного слоя атома углерода остается незанятой электронами, так что этот атом может быть акцептором электронной пары. Атом же кислорода сохраняет на одной из р-орбиталей неподеленную электронную пару и обладает, следовательно, электроно-донорными свойствами. В результате образуется еще одна ковалентная связь — донорно-акцепторная:
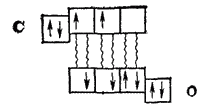
В образовавшейся таким образом молекуле каждый из атомов имеет во внешнем слое восемь электронов. Структуру молекулы СО можно изобразить схемой:
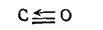
- 429 -
Здесь стрелкой показана связь, образованная по донорно-акцепторному способу.
Реакция образования оксида углерода(II) из простых веществ описывается уравнением:
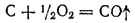
Стандартная энергия Гиббса этой реакции равна -137 кДж/моль, однако стандартная энергия Гиббса реакции
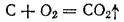
гораздо более отрицательна (-394 кДж/моль). Поэтому при невысоких температурах уголь сгорает до CO2, а оксид углерода, даже при недостатке кислорода, почти не образуется. Иначе обстоит дело при повышении температуры. По достижении 400-500°C начинает протекать реакция между углем и образовавшимся диоксидом углерода:

Эта реакция эндотермична и при 298 К изменение стандартной энергии Гиббса при ее протекании положительно (+120 кДж/моль). Однако в ходе превращения происходит двукратное увеличение числа молекул газа и энтропия системы сильно возрастает, так что энтропийное слагаемое энергии Гиббса имеет отрицательный знак. С увеличением температуры это слагаемое начинает преобладать (по абсолютной величине) над энтальпийным членом, в результате чего изменении энергии Гиббса при протекании реакции становится отрицательным. Уже при 800°C степень превращения CO2 в СО достигает 80%.
Рассмотренная реакция между углеродом и CO2, приводящая к образованию монооксида углерода, осуществляется в очень больших масштабах в доменном процессе (см. § 239), а также в газогенераторах (см. § 159).
В лабораториях оксид углерода(II) обычно получают, прибавляя муравьиную кислоту НСООН к нагретой серной кислоте. Последняя отнимает от муравьиной кислоты воду, выделяя оксид углерода (II):
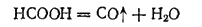
Эта реакция показывает, что оксид углерода (II) можно рассматривать как ангидрид муравьиной кислоты. Хотя муравьиная кислота не может быть получена непосредственно из оксида углерода (II) и воды, соли ее образуются при взаимодействии едких щелочей с оксидом углерода при 150-200°C:
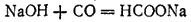
На воздухе оксид углерода горит голубоватым пламенем с выделением большого количества теплоты, превращаясь в CO2:
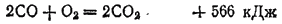
- 430 -
На солнечном свету или в присутствии активного угля (катализатор) оксид углерода непосредственно соединяется с хлором, образуя чрезвычайно ядовитый газ — фосген:
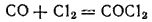
Фосген — важный промышленный продукт. Он применяется при производстве ряда органических и неорганических веществ, например красителей.
Оксид углерода(II) соединяется со многими металлами, образуя карбонилы металлов, например карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4. Последние два вещества представляют собой летучие, весьма ядовитые жидкости. Большинство карбонилов металлов—кристаллические вещества. Наибольшее практическое значение имеют карбонилы никеля, кобальта и железа. Они применяются для получения высокочистых металлов (см. § 193), для нанесения металлических покрытий. Кроме того, они служат катализаторами многих важных химических реакций.
Химические связи в молекулах карбонилов металлов образованы по донорно-акцепториому способу за счет неспаренных электронных пар молекулы СО и свободных орбиталей возбужденного атома металла. Например, у возбужденного атома железа имеются пять незанятых валентных орбиталей:
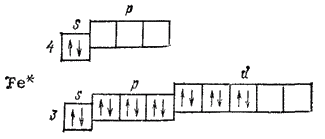
Поэтому молекула карбонила железа имеет состав, отвечающий формуле Fe(CO)5.
При повышенной температуре оксид углерода(II) — хороший восстановитель, играющий важную роль в металлургии при восстановлении металлов из их оксидов (см. §§ 192 и 239). Он используется также в качестве газообразного топлива (см. § 159) и входит в число исходных веществ в производстве ряда органических соединений.
Оксид углерода(II) очень ядовит и особенно опасен тем, что не имеет запаха; поэтому отравление им может произойти незаметно. Ядовитое действие оксида углерода, известное под названием угара, объясняется тем, что СО легко соединяется с гемоглобином крови и делает его неспособным переносить кислород от легких к тканям. При вдыхании свежего воздуха образовавшееся соединение (карбоксигемоглобин) постепенно разрушается, и гемоглобин восстанавливает способность поглощать кислород.
- 431 -
| <<< Назад 155. Диоксид углерода. Угольная кислота. |
Вперед >>> 157. Соединения углерода с серой и азотом. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- «Шепот» звезд
- Клестовик
- 4.6.4. Сравнительная характеристика представителей типа Плоские черви
- НАВОЗНИКИ ГЕОТРУПЫ
- К истокам Кочурлы
- 2.2. Клетка – единица строения, жизнедеятельности, роста и развития организмов. Многообразие клеток. Сравнительная харак...
- Секретный рецепт
- «Бездонный» бокал
- 706. Какой экологический вред наносят морские миноги?
- ПОИСК ЭКСПЕРИМЕНТАЛЬНЫХ ДОКАЗАТЕЛЬСТВ
- Почему стемнело только к полуночи и ненадолго? Разве там нет ночи?
- Путешествовать помогает ветер
