Книга: Общая химия
164. Предельные (насыщенные) углеводороды.
| <<< Назад 163. Классификация органических соединений. |
Вперед >>> 165. Непредельные (ненасыщенные) углеводороды. |
164. Предельные (насыщенные) углеводороды.
Простейший представитель класса предельных углеводородов — метан CH4. Это бесцветный легкий горючий газ, не имеющий запаха и почти нерастворимый в воде. Температура его кипения равна -161,5°C, температура затвердевания -182,5°C.
Метан довольно часто встречается в природе. Он является основной составной частью природного газа газовых месторождений (до 97%), в значительном количестве содержится в попутном нефтяном газе (выделяющемся при добыче нефти), а также в коксовом газе. Выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха, почему метан получил также название болотного газа. Наконец, метан постоянно скапливается в каменноугольных шахтах, где его называют рудничным газом.
Смесь метана с воздухом крайне взрывоопасна (особенно в соотношении 1:10).
Молекула метана характеризуется сравнительно большой прочностью. При обычных условиях метан активно (со взрывом) реагирует с фтором, очень медленно взаимодействует с хлором и почти не реагирует с бромом. Реакция с хлором или бромом ускоряется под действием света, а также при нагревании и заключается в последовательном замещении атомов водорода атомами галогена с образованием галогенпроизводных, например:
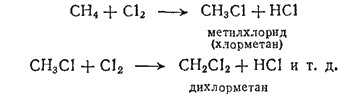
Метан горит синеватым или почти бесцветным пламенем, выделяя большое количество теплоты (879 кДж/моль). Однако при обычных условиях он не окисляется раствором перманганата калия (фиолетовая окраска раствора KMnO4 при контакте с предельными углеводородами не исчезает).
- 453 -
Как уже было указано, метан — первый представитель гомологического ряда предельных или насыщенных углеводородов:

В молекулах этих соединений все связи между атомами углерода простые (ординарные), атомы углерода максимально, до предела «насыщены» водородом. Состав любого из гомологов отвечает общей формуле CnH2n+2 (где n — число атомов углерода); эта закономерность дает возможность написать формулу состава для предельного углеводорода с любым числом С-атомов, например C18H28 (октадекан), C100H202 (гектан).
Состав одновалентных радикалов, получаемых отнятием атома водорода от молекулы предельного углеводорода, выражает формула CnH2n+1-. Названия их образуются заменой окончания -ан в названии углеводорода окончанием -ил. Так, от метана производится метил CH3-, от этана — этил C2H5-, от пропана — пропил C3H7- и т. д.
Как и в других гомологических рядах, в ряду метана проявляется всеобщий закон природы — закон перехода количественных изменений в качественные. Изменение состава молекулы на группу CH2 каждый раз приводит к новому веществу, которое хотя и имеет много общего с соседними членами ряда, но вместе с тем по некоторым свойствам отличается от них. Различие гомологов ясно проявляется в их физических свойствах. Низшие члены ряда предельных углеводородов (от CH4 до C4H10) - газы; средние члены (от C5H12 до C16H34) при температуре до 20°C — жидкости, остальные при обычных условиях находятся в твердом состоянии. Во всех случаях температуры кипения и затвердевания тем выше, чем больше молекулярная масса углеводорода.
В то же время предельные углеводороды в химическом отношении подобны метану. Они весьма инертны, вступают лишь в реакции замещения водорода, протекающие крайне медленно, и Не обесцвечивают на холоду растворы брома и перманганата калия.
Все предельные углеводороды горят и могут быть использованы в качестве топлива. Они входят в состав нефтей и продуктов Их перегонки. При фракционной перегонке нефть разделяют на отличающиеся по температурам кипения фракции («погоны») и получают следующие нефтепродукты:
а) бензины (темп. кип. 40-180°C) содержат углеводороды C5H12 до C10H22 при повторной перегонке из них могут быть быделены легкие нефтепродукты, кипящие в более узких пределах: петролейный эфир(40-70°C), авиационный бензин (70—100°C), автомобильный бензин (100—120°C);
б) керосины (темп. кип. 180-270°C) содержат углеводороды от C10H22 до C16H34;
- 454 -
в) соляровые масла (темп. кип. 270-360°C) содержат смеси углеводородов от C12 до C20 из них получают смазочные масла и различные виды дизельного топлива;
г) мазут (нефтяные остатки — до 40-50%) содержит еще более тяжелые (высшие) углеводороды; из мазута получают тяжелые смазочные масла, вазелин, парафин.
Как уже было указано, с увеличением числа С-атомов в молекулах резко возрастает число изомеров предельных углеводородов. Метан CH4, этан C2H6 и пропан C3H8 не имеют изомеров; бутанов C4H10 существует два:
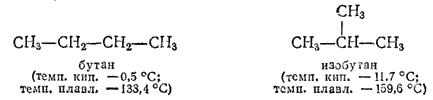
Изомерных пентанов C5H12— три, гексанов C6H14 - пять, гептанов C7H16 — девять, октанов C8H18 - 18, нонанов C9H20 - 35. Все эти углеводороды получены. Деканов C10H22 может быть 75, а формулу C15H32 могут иметь уже 4347 изомерных углеводородов. Для высших гомологов пока известны лишь некоторые изомеры, однако принципиальная возможность их существования предсказана и доказана А. М. Бутлеровым; им был осуществлен первый синтез углеводорода с разветвленной цепью — изобутана.
Как отдельные гомологи, так и изомеры отличаются друг от друга не только физическими, но и химическими свойствами. Сильная разветвленность углеродной цепи часто приводит к повышению температур замерзания, и высокое содержание таких углеводородов в бензинах может ограничивать возможность использования последних в зимних условиях.
Различие в химических свойствах сказывается, в частности, на склонности некоторых углеводородов, входящих в состав моторного топлива, к детонации.
Детонация моторного топлива представляет собой чрезвычайно быстрое разложение (взрыв) углеводородов, которое происходит внезапно при сжатии горючей смеси в цилиндре двигателя. Детонация не дает возможности достигнуть высокой степени сжатия горючей смеси*, ведет к излишнему расходу топлива и быстрому износу мотора. Детонационные свойства топлива зависят от строения углеродных цепей в молекулах углеводородов, входящих в его состав. Изомеры с сильно разветвленной цепью детонируют гораздо труднее, чем изомеры с неразветвленной цепью.
* Увеличение степени сжатия повышает мощность двигателя.
- 455 -
Антидетонационные свойства моторного топлива характеризуют так называемым октановым числом (о.ч.). В качестве стандартных образцов для определения октанового числа берут углеводород гептан C7H16 с неразветвленной цепью атомов, весьма легко детонирующий, и один из изомеров октана (изооктан), с разветвленной цепью атомов, мало склонный к детонации:
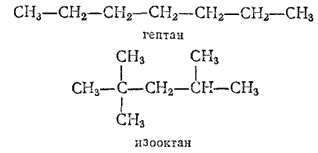
Октановое число гептана принимается равным нулю, а изооктану приписывается о.ч. 100. Если о.ч. топлива равно 80, то это значит, что данный вид топлива детонирует в смеси с воздухом (при такой же степени сжатия), как смесь, состоящая из 80% изооктана и 20% гептана.
Повышение октанового числа топлива достигается увеличением содержания в нем углеводородов с разветвленной цепью атомов, а также прибавлением антидетонаторов, обычно тетраэтилсвинца, небольшое количество которого значительно снижает детонацию.
Тетраэтилсвинец (ТЭС, «этиловая жидкость») представляет собой тяжелую ядовитую жидкость, строение молекул которой выражается формулой:
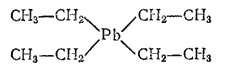
Тетраэтилсвинец относится к металлорганическим соединениям — веществам, в которых углеводородные радикалы непосредственно соединены с атомом какого-нибудь металла. Эти вещества находят все более широкое применение.
| <<< Назад 163. Классификация органических соединений. |
Вперед >>> 165. Непредельные (ненасыщенные) углеводороды. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
