Книга: Общая химия
169. Спирты и фенолы.
| <<< Назад 168. Галогенпроизводные углеводородов. |
Вперед >>> 170. Простые эфиры. |
169. Спирты и фенолы.
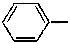
Спирты — производные предельных или непредельных углеводородов, в молекулах которых один или несколько атомов водорода заменены гидроксильными группами. Так, метиловый спирт (метанол) CH3-OH представляет собой гидроксильное производное метана CH4, этиловый спирт (этанол) CH3-CH2-OH — производное этана CH3-CH3. Производные ароматических углеводородов с группой ОН в бензольном ядре называются фенолами. Так, фенол C6H6-OH (или
Подобно молекулам воды (см. § 70), молекулы низших спиртов связываются между собой водородными связями. Поэтому они представляют собой ассоциированные жидкости и имеют более высокие температуры кипения, чем углеводороды, производными которых они являются, и чем другие органические вещества с таким же составом и молекулярной массой, но не содержащие гидроксильных групп.
- 465 -
Фенолы при обычных условиях находятся, как правило, в кристаллическом состоянии.
Общим свойством спиртов и фенолов является подвижность водорода гидроксильной группы. Так, при действии на спирт щелочного металла этот водород вытесняется металлом и получаются твердые, растворимые в спирте соединения, называемые алкоголятами, например:
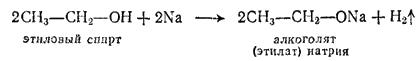
Формально такая реакция напоминает образование солей из кислот, однако алкоголяты подобны солям очень слабых кислот и нацело гидролизуются водой; при этом снова образуются спирт и щелочь:
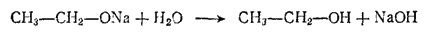
Поэтому при взаимодействии спиртов с водными растворами щелочей алкоголяты не образуются.
В фенолах под влиянием ароматического бензольного ядра подвижность водорода гидроксильной группы выше. Они образуют металлические производные — феноляты — не только при действии щелочных металлов, но, в отличие от спиртов, и при действии щелочей:
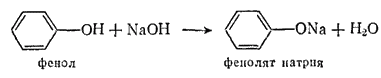
Феноляты в отличие от алкоголятов водой не разлагаются, но все же и они в водных растворах, подобно солям слабых кислот и сильных оснований, частично гидролизованы и их растворы имеют щелочную реакцию. Фенол вытесняется из фенолята даже угольной кислотой.
Спирты практически не являются электролитами. Константа диссоциации этилового спирта близка к 10-18 , тогда как константа диссоциации воды — к 10-16 , т. е. этиловый спирт является более слабой кислотой, чем вода. Константа диссоциации фенола несколько выше (1.3·10-10).
Спирты и фенолы взаимодействуют с кислотами, образуя сложные эфиры, например
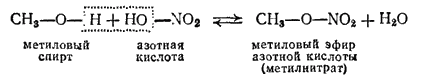
- 466 -
Особый интерес представляют сложные эфиры спиртов и фенолов с органическими кислотами (см. § 173).
Спирты значительно легче окисляются, чем соответствующие углеводороды. При этом образуются альдегиды или кетоны (см. § 171).
Метиловый спирт, или метанол, CH3OH — бесцветная жидкость (темп. кип. 64,5°C). Весьма ядовит-, прием небольших доз его внутрь вызывает слепоту, а больших - смерть. Метиловый спирт получают в больших количествах синтезом из оксида углерода (II), и водорода при высоком давлении (20-30 МПа) и высокой температуре (400°C) в присутствии катализатора (около 90% ZnO и 10% Cr2O3);
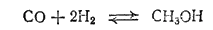
Метиловый спирт образуется и при сухой перегонке дерева; поэтому его называют также древесным спиртом. Применяется он как растворитель, а также для получения других органических веществ.
Этиловый (винный) спирт, или этанол, CH3CH2OH (темп. кип. 78.4°C) - одно из важнейших исходных веществ в современной промышленности органического синтеза. Для получения его издавна пользуются различными сахаристыми веществами, например виноградным сахаром, или глюкозой, которая путем «брожения», вызываемого действием ферментов (энзимов), вырабатываемых дрожжевыми грибками, превращается в этиловый спирт. Реакция протекает согласно схеме:
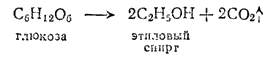
Глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16%.
Исходным продуктом для получения спирта может служить полисахарид крахмал (стр. 478), содержащийся, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы. Для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу. Для этого муку или измельченный картофель заваривают горячей водой и по охлаждении добавляют солод — проросшие, а затем подсушенные и растертые с водой зерна ячменя. В солоде содержится диастаз (сложная смесь ферментов), действующий на процесс осахаривания крахмала каталитически. По окончании осахаривания к полученной жидкости прибавляют дрожжи, под действием фермента которых (зимазы) образуется спирт. Его отгоняют и затем очищают повторной перегонкой.
В настоящее время осахариванию подвергают также другой полисахарид — целлюлозу (клетчатку), образующую главную массу древесины, Для этого целлюлозу подвергают гидролизу в присутствии кислот (например, древесные опилки при 150-170°C обрабатывают 0,1-5% серной кислотой под давлением 0,7-1,5 МПа).
- 467 -
Полученный таким образом продукт также содержит глюкозу и сбраживается на спирт при помощи дрожжей (гидролизный спирт).
Наконец, этиловый спирт может быть получен синтетическим путем из этилена. Суммарная реакция заключается в присоединении воды к этилену (в присутствии катализаторов):
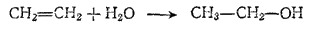
За последние годы в нашей стране построены заводы по производству синтетического этилового спирта из этилена и увеличилась выработка спирта из древесины. Это дало возможность сэкономить большое количество пищевых продуктов*.
Кроме спиртов с одной гидроксильной группой в молекуле (одноатомные спирты, или алкоголи), известны спирты, молекулы которых содержат несколько гидроксильных групп (многоатомные спирты).
Примерами таких спиртов могут служить двухатомный спирт этиленгликоль и трехатомный — глицерин:
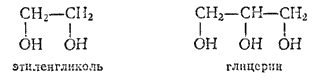
Этиленгликоль и глицерин - высококипящие жидкости сладкого вкуса, смешивающиеся с водой во всех отношениях. Этилен-гликоль применяется в качестве составной части так называемых антифризов, т. е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время. Водный раствор этиленгликоля (58%-ный) замерзает только при температуре -50°C. Этиленгликоль применяется и для изготовления синтетического волокна лавсан (см. § 177). При приеме внутрь — сильно ядовит.
Азотнокислые эфиры этиленгликоля и глицерина
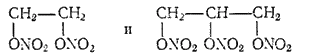
неправильно называемые нитроэтиленгликолем и нитроглицерином, обладают сильными взрывчатыми свойствами и применяются для изготовления динамитов.
Фенол C6H5OH — бесцветные кристаллы (темп, плавл. 41°C). Обладает характерным запахом и антисептическими (обеззараживающими — подавляющими развитие вредных микроорганизмов) свойствами.
* Из 5500 т сухих описок (отходы лесопильного завода средней производительности за год) можно получить 790 т спирта (считая на 100%). Это дает возможность сэкономить около 3000 т зерна или 10 000 т картофеля.
- 468 -
Как уже указывалось, кислотные свойства гидроксильного водорода выражены у фенола значительно сильнее, чем у спиртов; замещение этого водорода металлом может происходить не только при действии щелочных металлов, но и при действии щелочей. Поэтому фенол называют также карболовой кислотой.
Фенол содержится в каменноугольной смоле, а также получается синтетически из бензола. В больших количествах он идет на синтез лекарственных веществ, красителей, пластических масс (фенопластов, стр. 489), для очистки нефтяных смазочных масел.
| <<< Назад 168. Галогенпроизводные углеводородов. |
Вперед >>> 170. Простые эфиры. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- «Шепот» звезд
- Клестовик
- 4.6.4. Сравнительная характеристика представителей типа Плоские черви
- НАВОЗНИКИ ГЕОТРУПЫ
- К истокам Кочурлы
- 2.2. Клетка – единица строения, жизнедеятельности, роста и развития организмов. Многообразие клеток. Сравнительная харак...
- Секретный рецепт
- «Бездонный» бокал
- 706. Какой экологический вред наносят морские миноги?
- ПОИСК ЭКСПЕРИМЕНТАЛЬНЫХ ДОКАЗАТЕЛЬСТВ
- Почему стемнело только к полуночи и ненадолго? Разве там нет ночи?
- Путешествовать помогает ветер
