Книга: Общая химия
162. Теория химического строения органических соединений.
| <<< Назад 161. Отличительные особенности органических соединений. |
Вперед >>> 163. Классификация органических соединений. |
162. Теория химического строения органических соединений.
Химическая природа органических соединений, свойства, отличающие их от соединений неорганических, а также их многообразие нашли объяснение в сформулированной Бутлеровым в 1861 г. теории химического строения (см. § 38).
Согласно этой теории, свойства соединений определяются их качественным и количественным составом, химическим строением, т. е. последовательным порядком соединения между собой образующих молекулу атомов, и их взаимным влиянием. Теория строения органических соединений, развитая и дополненная новейшими воззрениями в области химии и физики атомов и молекул, особенно представлениями о пространственной структуре молекул, о природе химических связей и о характере взаимного влияния атомов, составляет теоретическую основу органической химии.
В современной теории строения органических соединений основными являются следующие положения.
- 439 -
1. Все особенности органических соединений определяются, прежде всего, свойствами элемента углерода.
В соответствии с местом, которое углерод занимает в периодической системе, во внешнем электронном слое его атома ( L-оболочка) имеются четыре электрона. Он не проявляет выраженной склонности отдавать или присоединять электроны, занимает в этом отношении промежуточное положение между металлами и неметаллами и характеризуется резко выраженной способностью образовывать ковалентные связи. Структура внешнего электронного слоя атома углерода может быть представлена следующими схемами:
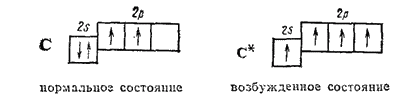
Возбужденный атом углерода может участвовать в образовании четырех ковалентных связей. Поэтому в подавляющем большинстве своих соединений углерод проявляет ковалентность, равную четырем.
Так, простейшее органическое соединение углеводород метан имеет состав CH4. Строение его можно изобразить структурой (а) или электронно-структурной (или электронной) (б) формулами:
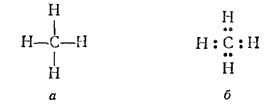
Электронная формула показывает, что атом углерода в молекуле метана имеет устойчивую восьмиэлектронную внешнюю оболочку (электронный октет), а атомы водорода — устойчивую двухэлектронную оболочку (электронный дублет).
Все четыре ковалентных связи углерода в метане (и в других подобных соединениях) равноценны и симметрично направлены в пространстве. Атом углерода находится как бы в центре тетраэдра (правильной четырехгранной пирамиды), а четыре соединенных с ним атома (в случае метана — четыре атома водорода) - в вершинах тетраэдра (рис. 120). Углы между направлениями любой пары связей (валентные углы углерода) одинаковы и составляют 109° 28'.
Это объясняется тем, что в атоме углерода, когда он образует ковалентные связи с четырьмя другими атомами, из одной s- и трех р-орбиталей в результате sp3-гибридизации образуются четыре симметрично расположенные в пространстве гибридные sp3-орбитали, вытянутые в направлении к вершинам тетраэдра.
- 440 -
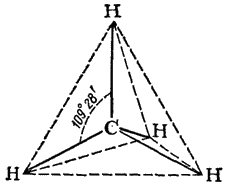
Рис. 120. Тетраэдрическая модель молекулы метана.
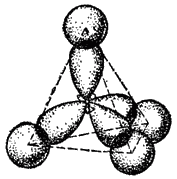
Рис. 121. Схема образования ?-связей в молекуле метана.
В результате перекрывания sp3-гибридных электронных облаков углерода с электронными облаками других атомов (в метане - с шаровыми облаками 1s-электронов атомов водорода) образуются четыре тетраэдрически направленные ковалентные ?-связи (рис. 121; см. также стр. 131).
Тетраэдрическое строение молекулы метана наглядно выражается ее пространственными моделями — шариковой (рис. 122) или сегментовой (рис. 123). Белые шарики (сегменты) изображают атомы водорода, черные — углерода. Шариковая модель характеризует лишь взаимное пространственное расположение атомов, сегментовая — дает, кроме того, представление об относительных межатомных расстояниях (расстояниях между ядрами). Как показано на рис. 122, структурная формула метана может рассматриваться как проекция его пространственной модели на плоскость чертежа.
2. Исключительным свойством углерода, обусловливающим многообразие органических соединений, является способность его атомов соединяться прочными ковалентными связями друг с другом, образуя углеродные цепи практически неограниченной длины
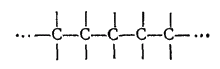
Валентности атомов углерода, не пошедшие на взаимное соединение, используются для присоединения других атомов или групп (в углеводородах — для присоединения водорода).
Так, углеводороды этан (C2H6) и пропан (C3H8) содержат цепи соответственно из двух и трех атомов углерода.
- 441 -
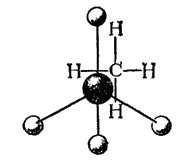
Рис. 122. Шариковая модель молекулы метана.
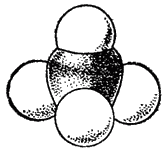
Рис. 123. Сегментовая модель молекулы метана.
Строение их выражают следующие структурные и электронные формулы:
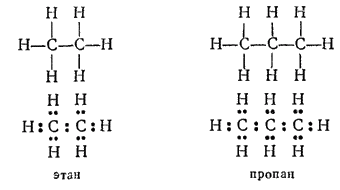
Известны соединения, содержащие в цепях сотни и более атомов углерода.
Наращивание углеродной цепи на один атом углерода ведет к увеличению состава на группу CH2. Такое количественное изменение состава приводит к новому соединению, обладающему несколько иными свойствами, т. е. уже качественно отличающемуся от исходного соединения; однако общий характер соединений сохраняется. Так, кроме углеводородов метана (CH4), этана (C2H6), пропана (C3H8) существуют бутан (C4H10), пентан (C5H12) и т. д. Таким образом, в огромном многообразии органических веществ могут быть выделены ряды однотипных соединений, в которых каждый последующий член отличается от предыдущего на группу CH2. Такие ряды называют гомологическими рядами, их члены по отношению друг к другу являются гомологами, а существование таких рядов называется явлением гомологии.
Следовательно, углеводороды метан, этап, пропан, бутан и т. д. — гомологи одного и того же ряда, который называют рядом предельных, или насыщенных, углеводородов (алканов) или, по первому представителю, - рядом метана.
Вследствие тетраэдрической направленности связей углерода, его атомы, входящие в цепь, располагаются не на прямой, а зигзагообразно, причем, благодаря возможности вращения атомов вокруг оси связи, цепь в пространстве может принимать различные формы (конформации):
- 442 -
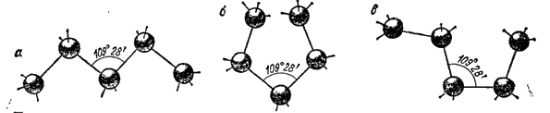
Такая структура цепей дает возможность сближаться концевым (б) или другим не смежным атомам углерода (в); в результате возникновения связи между этими атомами углеродные цепи могут замыкаться в кольца (циклы), например:
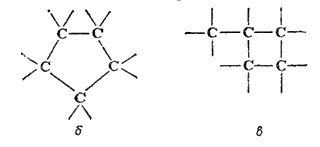
Таким образом, многообразие органических соединений определяется и тем, что при одинаковом числе атомов углерода в молекуле возможны соединения с открытой, незамкнутой цепью углеродных атомов, а также вещества, молекулы которых содержат циклы (циклические соединения).
3. Ковалентные связи между атомами углерода, образованные одной парой обобщенных электронов, называют простыми (или ординарными) связями.
Связь между атомами углерода может осуществляться не одной, а двумя или тремя общими парами электронов. Тогда получаются цепи с кратными — двойными или тройными связями; эти связи можно изобразить следующим образом:

Простейшие соединения, содержащие кратные связи, - углеводороды этилен (с двойной связью) и ацетилен (с тройной связью):
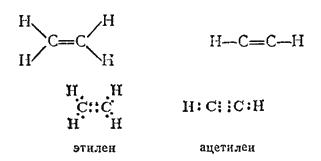
Углеводороды с кратными связями называются непредельными или ненасыщенными. Этилен и ацетилен — первые представители двух гомологических рядов — этиленовых и ацетиленовых углеводородов.
- 443 -

Рис. 124. Схема образования ?-связей в молекуле этана.
Простая ковалентная связь C-C (или С:С), образованная перекрыванием двух sp3-гибридных электронных облаков по линии, соединяющей центры атомов (по оси связи), как, например, в этане (рис. 124), представляет собой ?-связь (см. § 42). Связи C-H также являются ?-связями — они образуются перекрыванием по оси связи sp3-гибридного облака атома С и шарового облака 1s-электрона атома Н.
Природа кратных углерод-углеродных связей несколько иная. Так, в молекуле этилена при образовании двойной ковалентной связи C=C (или C::C) в каждом из атомов углерода в гибридизации участвует одна s-орбиталь и только две р-орбнтали (sp2-гибридизация); одна из р-орбиталей каждого атома С не гибридизуется. В результате образуются три sp2-гибридных электронных облака, которые участвуют в образовании трех ?-связей. Всего в молекуле этилена пять ?-связей (четыре C-H и одна C-C); все они расположены в одной плоскости под углами около 120° друг к другу (рис. 125).
Таким образом, одна из электронных пар в связи C=C осуществляет ?-связь, а вторая — образуется р-электронами, не участвующими в гибридизации; их облака сохраняют форму объемной восьмерки ("гантели"), ориентированы перпендикулярно к плоскости, в которой расположены ?-связи, и перекрываются над и под этой плоскостью (рис. 126), образуя ?-связь (см. § 42).
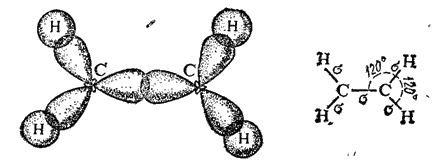
Рис. 125. Схема образования ?-связей в молекуле этилена.
- 444 -
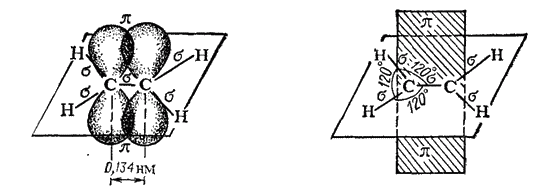
Рис. 126. Схема образования ?-связи в молекуле этилена.
Следовательно, двойная связь С = С представляет собой сочетание одной ? и одной ?-связей.
Тройная связь ? (или ??) является сочетанием одной ?-связи и двух ?-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна s-орбиталь и только одна р-орбиталь (sp-гибридизация); в результате образуются два sp-гибридных электронных облака, участвующих в образовании двух ?-связей. Облака двух р-электронов каждого атома С не гибридизуются, сохраняют свою конфигурацию и участвуют в образовании двух ?-связей. Таким образом, в ацетилене всего три ?-связи (одна C-C и две C-H), направленные вдоль одной прямой, и две ?-связи, ориентированные в двух взаимно перпендикулярных плоскостях (рис. 127).
Кратные (т. е. двойные и тройные) связи при реакциях легко превращаются в простые; тройная вначале переходит в двойную, а последняя — в простую. Это обусловлено их высокой реакционной способностью и имеет место при присоединении каких-либо атомов к паре атомов углерода, связанных кратной связью.
Переход кратных связей в простые объясняется тем, что обычно ?-связи обладают меньшей прочностью и поэтому большей лабильностью по сравнению с p-связями. При образовании ?-связей р-электронные облака с параллельными осями перекрываются в значительно меньшей степени, чем электронные облака, перекрывающиеся по оси связи (т. е. гибридные, s-электронные или ориентированные вдоль оси связи р-электронные облака).
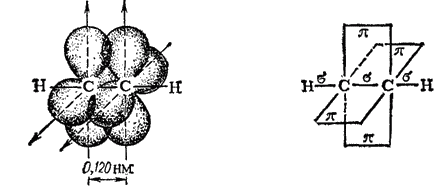
Рис. 127. Схема образования ?-связей в молекуле ацетилена.
- 445 -
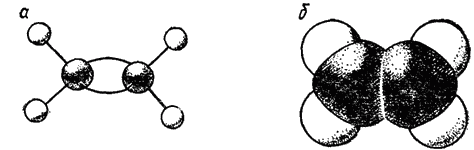
Рис. 128. Модели молекулы этилена: а - шариковая; б — сегментовая.
Кратные связи прочнее простых. Так, энергия разрыва связи C?C составляет 535 кДж/моль, связи C=C - 423 кДж/моль , а связи C-C только 264 кДж/моль.
Из сказанного следует, что в формулах две черточки из трех в связи C?C и одна черточка из двух в связи C=C выражают связи менее прочные, чем простая связь C-C.
На рис. 128 и 129 представлены шариковые и сегментовые пространственные модели соединений с двойной (этилен) и с тройной (ацетилен) связями.
4. Теория строения объяснила многочисленные случаи изомерии органических соединений.
Цепи из атомов углерода могут быть неразветвленными или разветвленными:
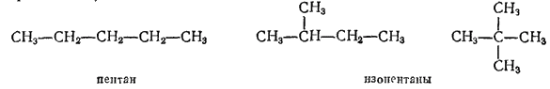
Так, состав C5H12 имеют три предельных углеводорода (пентана) с различным строением цепей — один с неразветвленной цепью (нормального строения) и два с разветвленной (изостроения):
Состав C4H8 имеют три непредельных углеводорода (бутилена) - два нормального строения, но изомерные по положению двойной связи и один — изостроения:
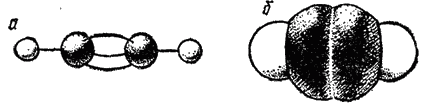
Рис. 129. Модели молекулы ацетилена: а шариковая; б — сегментовая.
- 446 -
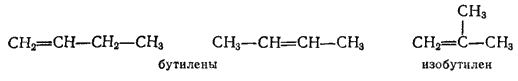
Этим непредельным соединениям изомерны два циклических углеводорода, также имеющие состав C4H8 и изомерные друг другу по величине цикла:
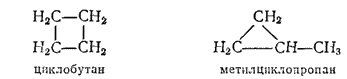
При одном и том же составе соединения могут различаться по строению вследствие различного положения в углеродной цепи и других, не углеродных, атомов, например:
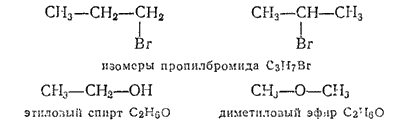
Изомерия может быть обусловлена не только различным порядком соединения атомов. Известно несколько видов пространственной изомерии (стереоизометрии), заключающейся в том, что соответствующие изомеры (стереоизомеры) при одинаковом составе и порядке соединения атомов отличаются различным расположением атомов (или групп атомов) в пространстве.
Так, если в соединении имеется атом углерода, связанный с четырьмя разными атомами или группами атомов (асимметрический атом), то возможны две пространственно-изомерные формы такого соединения. На рис. 130 представлены две тетраэдрические модели молочной кислоты
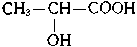
* Наличие такого атома приводит к асимметрии молекул; очевидно, что обе модели на рис. 130 несимметричны - ни через одну из них невозможно провести плоскость симметрии.
- 447 -
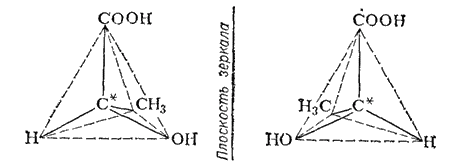
Рис. 130. Тетраэдрические модели молекул зеркальных изомеров молочной кислоты.
Различие в пространственном строении зеркальных изомеров может быть представлено и при помощи структурных формул, в которых показано различное расположение атомных групп при асимметрическом атоме; например, для приведенных на рис. 130 зеркальных изомеров молочной кислоты:
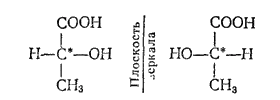
Как уже указано, атомы углерода; соединенные двойной связью, лежат в одной плоскости с четырьмя связями, соединяющими их с другими атомами; углы между направлениями этих связей приблизительно одинаковы (рис. 126). Когда с каждым из атомов углерода при двойной связи соединены различные атомы или группы, возможна так называемая геометрическая стереоизомерия, или цис-транс-изомерия. Примером могут служить пространственные геометрические изомеры дихлорэтилена CHCl?CHCl:
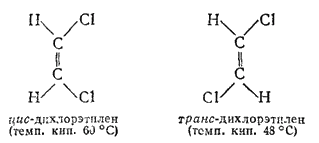
В молекулах одного изомера атомы хлора расположены по одну сторону двойной связи, а в молекулах другого — по разные стороны. Первая конфигурация называется цис-, вторая — транс-конфигурацией. Геометрические изомеры отличаются друг от друга по физическим и химическим свойствам.
- 448 -
Существование их обусловлено тем, что двойная связь исключает возможность свободного вращения соединенных ею атомов вокруг оси связи (такое вращение требует разрыва ?-связи; см. рис. 126).
5. Взаимное влияние в молекулах органических веществ проявляют прежде всего атомы, непосредственно связанные друг с другом. В этом случае оно определяется характером химической связи между ними, степенью различия в их относительной электроотрицательности и, следовательно, степенью полярности связи.
Например, если судить по суммарным формулам, то в молекуле метана (CH4) и в молекуле метилового спирта (CH4O) все четыре атома водорода должны обладать одинаковыми свойствами. Но, как будет показано дальше, в метиловом спирте один из атомов водорода способен замещаться щелочным металлом, тогда как в метане атомы водорода такой способности не проявляют. Это объясняется тем, что в спирте атом водорода непосредственно связан не с углеродом, а с кислородом

В приведенных структурных формулах стрелками на черточках связей условно показано смещение пар электронов, образующих ковалентную связь, вследствие различной электроотрицательности, атомов. В метане такое смещение в связи H?O невелико, поскольку электроотрицательность углерода (2,5) лишь незначительно превышает электроотрицательность водорода (2,1) табл. 6, стр. 118). При этом молекула метана симметрична. В молекуле же спирта связь O?H значительно поляризована, поскольку кислород (электроотрицательность 3,5) гораздо больше оттягивает на себя электронную пару; поэтому атом водорода, соединенный с атомом кислорода, приобретает большую подвижность, т. е. легче отрывается в виде протона.
В органических молекулах имеет значение также взаимное влияние атомов, не связанных друг с другом непосредственно. Так, в метиловом спирте под влиянием кислорода увеличивается реакционная способность не только атома водорода, связанного с кислородом, но и атомов водорода, непосредственно с кислородом не связанных, а соединенных с углеродом. Благодаря этому метиловый спирт довольно легко окисляется, тогда как метан относительно устойчив к действию окислителей. Это объясняется тем, что кислород гидроксильной группы значительно оттягивает на себя пару электронов в связи
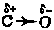
- 449 -
В результате эффективный заряд атома углерода становится более положительным, что вызывает дополнительное смещение пар электронов также и в связях H?C в метиловом спирте, сравнительно с теми же связями в молекуле метана. При действии окислителей атомы Н, связанные с тем же атомом углерода, с которым связана группа ОН, значительно легче, чем в углеводородах, отрываются и соединяются с кислородом, образуя воду. При этом атом углерода, связанный с группой ОН, подвергается дальнейшему окислению (см. § 171).
Взаимное влияние атомов, непосредственно друг с другом не связанных, может передаваться на значительное расстояние по цепи атомов углерода и объясняется смещением плотности электронных облаков во всей молекуле под влиянием имеющихся в ней различных по электроотрицательности атомов или групп. Взаимное влияние может передаваться и через пространство, окружающее молекулу, — в результате перекрывания электронных облаков сближающихся атомов.
| <<< Назад 161. Отличительные особенности органических соединений. |
Вперед >>> 163. Классификация органических соединений. |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- 38. Теория химического строения.
- Глава IV Примеры построения математических моделей опасных атмосферных явлений
- § 15. Методы изучения внутреннего строения Земли
- 1. Особенности строения бактериальной клетки. Основные органеллы и их функции
- 5.4.1.Нервная система. Общий план строения. Функции
- 2.1. Клеточная теория, ее основные положения, роль в формировании современной естественнонаучной картины мира. Развитие ...
- 4.2. Царство Бактерии. Особенности строения и жизнедеятельности, роль в природе. Бактерии – возбудители заболеваний раст...
- 1.2. Признаки и свойства живого: клеточное строение, особенности химического состава, обмен веществ и превращения энерги...
- 2.3. Химическая организация клетки. Взаимосвязь строения и функций неорганических и органических веществ (белков, нуклеи...
- 2.2. Клетка – единица строения, жизнедеятельности, роста и развития организмов. Многообразие клеток. Сравнительная харак...
- 2.4. Строение про– и эукариотной клеток. Взаимосвязь строения и функций частей и органоидов клетки – основа ее целостнос
- 4.7. Хордовые животные, их классификация, особенности строения и жизнедеятельности, роль в природе и жизни человека. Хар...
