Книга: Общая химия
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
| <<< Назад 122. Кислородсодержащие соединения галогенов. |
Вперед >>> КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух. |
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
Элементы главной подгруппы шестой группы периодической системы это кислород, сера, селен, теллур и полоний. Последний из них — радиоактивный металл; известны как природные, так и искусственно полученные его изотопы.
Во внешней электронной оболочке атомы рассматриваемых элементов содержат шесть электронов — два на p-орбитали и четыре на р-орбитали. Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое:
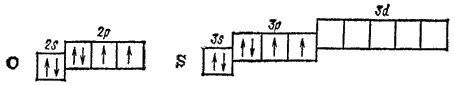
Как указывалось в § 41, такая электронная структура атома кислорода обусловливает большие энергетические затраты на «распаривание» его электронов, не компенсируемые энергией образования новых ковалентных связей. Поэтому ковалентность кислорода, как правило, равна двум. Однако в некоторых случаях атом кислорода, обладающий неподеленнымн электронными парами, может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцепторному способу.
У серы и у остальных элементов подгруппы число неспаренных электронов в атоме может быть увеличено путем перевода s- и р-электронов на d-подуровень внешнего слоя. В связи с этим указанные элементы проявляют ковалентность, равную не только 2, но также 4 и 6.
Все элементы данной подгруппы, кроме полония, неметаллы, хотя и менее активные, чем галогены. В своих соединениях они проявляют как отрицательную, так и положительную окисленность. В соединениях с металлами и с водородом их степень окисленности, как правило, равна —2. В соединениях с неметаллами, например с кислородом, она может иметь значение +4 или +6. Исключение при этом составляет сам кислород. По величине электроотрицательности он уступает только фтору (см. табл. 6 на стр. 118); поэтому только в соединении с этим элементом (OF2) его окисленность положительна (+2). В соединениях со всеми другими элементами окисленность кислорода отрицательна и обычно равна —2. В пероксиде водорода и его производных (см. § 117) она равна —1.
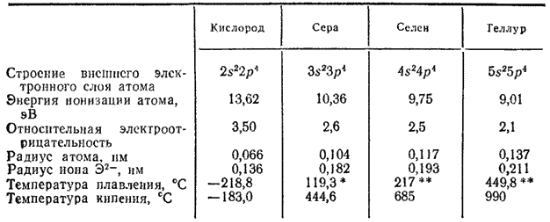
Как и в группе галогенов, физические и химические свойства рассматриваемых элементов закономерно изменяются с увеличением порядкового номера. Появление новых электронных слоев влечет за собой увеличение радиусов атомов, уменьшение электроотрицательности, понижение окислительной активности незаряженных атомов и усиление восстановительных свойств атомов со степенью окисленности —2.
Таблица 25. Некоторые свойства кислорода и его аналогов
- 361 -
Поэтому неметаллические свойства, ярко выраженные у кислорода, оказываются очень ослабленными у теллура.
Некоторые свойства элементов главной подгруппы шестой группы приведены в табл. 25.
| <<< Назад 122. Кислородсодержащие соединения галогенов. |
Вперед >>> КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух. |
- КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- ДНК — главная «шестеренка» наследственности
- Ежедневно 20 ведер воды на шестой этаж
- Главная молекула жизни
- 4.9. Естественный отбор – главная движущая сила эволюции
- 9. Естественный отбор – главная движущая сила эволюции
- Глава XIII Регуляция экспрессии генов
- Миф № 13 Главная идея Чарльза Дарвина – что «человек произошел от обезьяны»
- Миф № 15 Главная идея Дарвина – что бога нет…
- Самая главная молекула. От структуры ДНК к биомедицине XXI века
- Глава XIII ПЫЛЕВЫЕ ОКОЛОПЛАНЕТНЫЕ КОМПЛЕКСЫ
- 1.2. Главная загадка ночного неба
