Книга: Общая химия
189. Свинцовый аккумулятор.
| <<< Назад 188. Свинец (Plumbum). |
Вперед >>> Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ |
189. Свинцовый аккумулятор.
Готовый к употреблению свинцовый аккумулятор состоит из решетчатых свинцовых пластин, одни из которых заполнены диоксидом свинца, а другие — металлическим губчатым свинцом. Пластины погружены в 35-40% раствор H2SO4 при этой концентрации удельная электрическая проводимость раствора серной кислоты максимальна.
При работе аккумулятора — при его разряде — в нем протекает окислительно-восстановительная реакция, в ходе которой металлический свинец окисляется
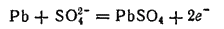
а диоксид свинца восстанавливается:
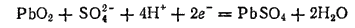
Электроны, отдаваемые атомами металлического свинца при окислении, принимаются атомами свинца PbO2 при восстановлении; электроны передаются от одного электрода к другому по внешней цепи.
Таким образом, металлический свинец служит в свинцовом аккумуляторе анодом и заряжен отрицательно, а PbO2 служит катодом и заряжен положительно.
Во внутренней цепи (в растворе H2SO4) при работе аккумулятора происходит перенос ионов. Ионы SO42- движутся к аноду, а ионы H+— к катоду. Направление этого движения обусловлено электрическим полем, возникающим в результате протекания электродных процессов: у анода расходуются анионы, а у катода — катионы. В итоге раствор остается электронейтральным.
Если сложить уравнения, отвечающие окислению свинца и восстановлению PbO2, то получится суммарное уравнение реакции, протекающей в свинцовом аккумуляторе при его работе (разряде):
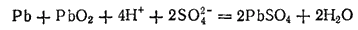
Э. д. с. заряженного свинцового аккумулятора равна приблизительно 2 В. По мере заряда аккумулятора материалы его катода (PbO2) и анода (Рb) расходуются. Расходуется и серная кислота. При этом напряжение на зажимах аккумулятора падает. Когда оно становится меньше значения, допускаемого условиями эксплуатации, аккумулятор вновь заряжают.
Для зарядки (или заряда) аккумулятор подключают к внешнему источнику тока (плюсом к плюсу и минусом к минусу). При этом ток протекает через аккумулятор в направлении, обратном тому, в котором он проходил при разряде аккумулятора, В результате этого электрохимические процессы на электродах «обращаются».
- 513 -
На свинцовом электроде теперь происходит процесс восстановления
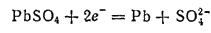
т. е. этот электрод становится катодом.
Электролит свинцового аккумулятора представляет собой раствор серной кислоты, содержащий сравнительно малое количество ионов Pb2+. Концентрация ионов водорода в этом растворе намного больше, чем концентрация ионов свинца. Кроме того, свинец в ряду напряжений стоит до водорода. Тем не менее при зарядке аккумулятора на катоде восстанавливается именно свинец, а не водород. Это происходит потому, что перенапряжение выделения водорода на свинце особенно велико (см. табл. 20 на стр. 295).
На электроде из PbO2 при зарядке идет процесс окисления
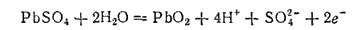
следовательно, этот электрод является теперь анодом. Ионы в растворе движутся в направлениях, обратных тем, в которых они перемещались при работе аккумулятора.
Складывая два последние уравнения, получим уравнение реакции, протекающей при зарядке аккумулятора:
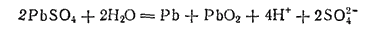
Нетрудно заметить, что этот процесс противоположен тому, который протекает при работе аккумулятора: при зарядке аккумулятора в нем вновь получаются вещества, необходимые для его работы.
| <<< Назад 188. Свинец (Plumbum). |
Вперед >>> Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ |
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- Аккумуляторы бодрости
- Аккумулятор Уфимцева
- 12.4.2. Перенапряжение
- КРЕМНИЙ
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
- 186. Германий (Germanium).
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 176. Аминокислоты и белки.
- 188. Свинец (Plumbum).
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
