Книга: Общая химия
38. Теория химического строения.
| <<< Назад Глава IV. Химическая связь и строение молекул |
Вперед >>> 39. Ковалентная связь. Метод валентных связей. |
38. Теория химического строения.
Основу теории, разработанной А. М. Бутлеровым, составляют следующие положения:
1. Атомы в молекулах соединены друг с другом в определенной последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
2. Соединение атомов происходит в соответствии с их валентностью.
3. Свойства веществ зависят не только от их состава, но и от их «химического строения», т.е. от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
Александр Михайлович Бутлеров родился 25 августа 1828 г. в г. Чистополе Казанской губернии. В 1849 г. он окончил Казанский университет, где его учителями были выдающиеся русские химики К. К. Клаус и Н. Н. Зинин.
После окончания университета Бутлеров был оставлен при нем для подготовки к профессорскому званию. В 1851 г. Бутлеров защитил диссертацию на тему «Об окислении органических соединений» и получил степень магистра, а в 1854 г., после защиты диссертации «Об эфирных маслах», он был утвержден в степени доктора и избран профессором Казанского университета.
В 1868 г. совет Петербургского университета по предложению Менделеева избрал Бутлерова ординарным профессором по кафедре органической химии, после чего вся его научная и педагогическая деятельность протекала в Петербурге.
С первых же шагов своей научной деятельности Бутлеров проявил себя блестящим экспериментатором и осуществил ряд замечательных синтезов. Экспериментаторский талант Бутлерова сочетается с широкими теоретическими обобщениями и научным предвидением. Бутлеров был убежден в возможности выразить формулами строение молекул химических соединений и притом сделать это путем изучения их химических превращений.
В 1861 г. Бутлеров выступает на съезде немецких естествоиспытателей и врачей с докладом «О химическом строении веществ». Этот доклад открыл целую эпоху в химии. Вернувшись в Казань, Бутлеров детально развивает новое учение.
В 1862-1863 гг. Бутлеров пишет «Введение к полному изучению органической химии», в котором располагает весь фактический материал органической химии на основе строго научной классификации, вытекающей из теории химического строения. Принятая в этой книге классификация органических соединений сохранилась в своих главных чертах до наших дней.
Бутлеров воспитал блестящую плеяду учеников, продолжавших развивать его идеи. Из его школы вышли такие выдающиеся ученые, как В. В. Марковников, А. Е. Фаворский и многие другие.
- 111 -
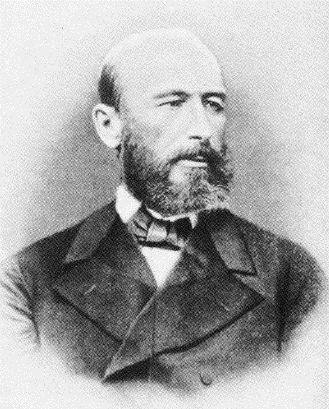
Александр Михайлович Бутлеров (1828 — 1886)
Таким образом, согласно теории Бутлерова свойства веществ определяется не только их качественным и количественным составом, как считали раньше, но и внутренней структурой молекул, определенным порядком соединения между собой атомов, образующих молекулу. Эту внутреннюю структуру Бутлеров называл «химическим строением».
Особенно важной была идея Бутлерова о том, что атомы, соединяясь в определенной последовательности в соответствии с их валентностью, взаимно влияют друг на друга таким образом, что частично изменяется их собственная природа, их «химическое содержание». Так, свойства атома водорода существенно меняются в зависимости от того, соединен ли он с атомом хлора (в молекуле HCl), кислорода (в молекуле H2O) или азота (в молекуле NH3). В первом случае в водных растворах атом водорода сравнительно легко отщепляется от молекулы HCl в виде иона H+, что и обусловливает кислотные свойства хлороводорода; от молекулы воды ион водорода отщепляется с гораздо большим трудом, так что кислотные свойства выражены у воды весьма слабо; наконец, для молекулы аммиака отщепление иона водорода еще менее характерно — аммиак ведет себя как основание. Особенно многообразно проявляется взаимное влияние атомов в молекулах органических соединений (стр. 448, 449).
Учение Бутлерова позволило ориентироваться в огромном разнообразии веществ, дало возможность определять строение молекул на основании изучения их химических свойств, предугадывать свойства веществ по строению их молекул, намечать пути синтеза различных соединений.
Из теории Бутлерова вытекает возможность изображать строение молекул в виде структурных формул, в которых указана последовательность соединения атомов друг с другом, а каждая черточка, соединяющая атомы, обозначает единицу валентности. Так, строение молекул хлороводорода (HCl), хлорноватистой (HClO) и хлорноватой (HClO3) кислот выражается следующими структурными формулами:
- 112 -
|
H — Cl |
H — O — Cl |
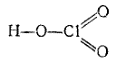
|
|
хлороводород |
Хлорноватистая кислота |
Хлорноватая кислота |
Эти формулы прежде всего показывают, что только в молекуле HCl атом водорода непосредственно связан с атомом хлора, тогда как в молекулах HClO и HClO3 он соединен не с хлором а с атомом кислорода. Кроме того, структурная формула хлорноватой кислоты указывает на неравноценность атомов кислорода; в ее молекуле каждый из двух атомов кислорода соединен с атомом хлора двумя валентными связями, а третий связан одновременно в атомами хлора и водорода.
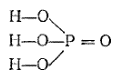
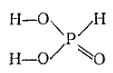
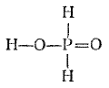
Структурные формулы позволяют, например, понять причину различий в некоторых свойствах ортофосфорной (H3PO4), фосфористой (H3PO3) и фосфорноватистой (H3PO2) кислот. Молекулы каждой из этих кислот содержат по три атома водорода. Приведем их структурные формулы:
|
|
|
|
|
Ортофосфорная кислота |
Фосфористая кислота |
Фосфорноватистая кислота |
Как видно, в молекуле ортофосфорный кислоты каждый атом водорода соединен с атомом кислорода. Все эти атомы водорода способны замещаться атомами металлов: поэтому H3PO4 трехосновна. В молекуле фосфористой кислоты только два атома водорода непосредственно связаны с атомами кислорода и способны замещаться атомами металлов: эта кислота двухосновна. В молекуле же фосфорноватистой кислоты с атомом кислорода связан лишь один атом водорода, что и обусловливает ее одноосновность.
Изображение химического строения молекул с помощью структурных формул особенно важно при изучении органических веществ (см. § 163).
Структурные формулы отражают лишь последовательность соединения атомов друг с другом, а не взаимное расположение атомов в пространстве. Изображение химического строения с помощью структурных формул допустимо только для веществ, состоящих из молекул. Между тем многие вещества состоят не из молекул, а из атомов (например, карбид кремния SiC). Структура подобных веществ определяется типом их кристаллической решетки и будет подробнее рассмотрена в гл. V.
- 113 -
Теория химического строения объяснила явление изомерии, которое заключается в существовании соединений, обладающих одним и тем же качественным и количественным составом, но разными свойствами. Такие соединения были названы изомерами.
Явление изомерии будет подробно рассмотрено при изучении органических соединений (см. § 162), среди которых оно очень распространено. Следует, однако, иметь в виду, что изомерия присуща и неорганическим веществам. Так, еще в 1824 г. Либих установил, что серебряные соли гремучей кислоты AgONC и циановой кислоты AgNCO имеют одинаковый состав, тогда как свойства этих веществ сильно различаются. С примерами изомерии мы встретимся и при изучении комплексных соединений (см. § 205).
Разрабатывая теорию химического строения, Бутлеров не ставил перед собой задачу выяснения природы химической связи, справедливо считая, что химия в то время еще не была готова к решению этой задачи. Действительно, необходимой предпосылкой создания теории химической связи было выяснение строения атома. Лишь после того, как стали известны основные черты электронной структуры атомов, появилась возможность для разработки такой теории. В 1916 г. американский физико-химик Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам; эта идея послужила исходным пунктом для разработки современной теории ковалентной связи. В том же 1916 г. немецкий ученый В. Коссель предположил, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны; при этом первый атом превращается в положительно заряженный, а второй — в отрицательно заряженный ион; взаимное электростатическое притяжение образовавшихся ионов и приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений о ионной связи.
| <<< Назад Глава IV. Химическая связь и строение молекул |
Вперед >>> 39. Ковалентная связь. Метод валентных связей. |
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- 162. Теория химического строения органических соединений.
- Глава IV Примеры построения математических моделей опасных атмосферных явлений
- § 15. Методы изучения внутреннего строения Земли
- 1. Особенности строения бактериальной клетки. Основные органеллы и их функции
- 5.4.1.Нервная система. Общий план строения. Функции
- 2.1. Клеточная теория, ее основные положения, роль в формировании современной естественнонаучной картины мира. Развитие ...
- 4.2. Царство Бактерии. Особенности строения и жизнедеятельности, роль в природе. Бактерии – возбудители заболеваний раст...
- 1.2. Признаки и свойства живого: клеточное строение, особенности химического состава, обмен веществ и превращения энерги...
- 2.3. Химическая организация клетки. Взаимосвязь строения и функций неорганических и органических веществ (белков, нуклеи...
- 2.2. Клетка – единица строения, жизнедеятельности, роста и развития организмов. Многообразие клеток. Сравнительная харак...
- 2.4. Строение про– и эукариотной клеток. Взаимосвязь строения и функций частей и органоидов клетки – основа ее целостнос
- 4.7. Хордовые животные, их классификация, особенности строения и жизнедеятельности, роль в природе и жизни человека. Хар...
