Книга: Общая химия
142. Азотная кислота.
| <<< Назад 141. Азотистая кислота. |
Вперед >>> 143. Промышленное получение азотной кислоты. |
142. Азотная кислота.
Чистая азотная кислота HNO3 - бесцветная жидкость плотностью 1,51 г/см3, при -42°C застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана.
Азотная кислота не отличается прочностью. Уже под влиянием света она постепенно разлагается:
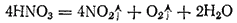
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы H+ и NO3-.
Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота —один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO3, ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы — в оксиды.
Концентрированная HNO3 пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO3. Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние (см. § 100).
Степень окисленности азота в азотной кислоте равна +5. Выступая в качестве окислителя, HNO3 может восстанавливаться до различных продуктов:

Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрация HNO3, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется NO2. При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется NO. В случае более активных металлов — железа, цинка — образуется N3O.
Сильно разбавленная азотная кислота взаимодействует с активными металлами — цинком, магнием, алюминием — с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой:
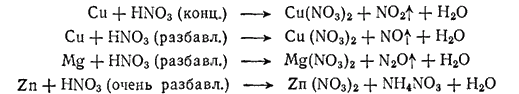
При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении неметаллов концентрированная азотная кислота, как и в случае металлов, восстанавливается до NO2, например
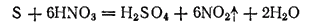
Более разбавленная кислота обычно восстанавливается до NO, например:

Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием HNO3, протекают сложно.
Смесь, состоящая из 1 объема азотной и 3—4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азога (III), или хлорида нитрозила, NOCl:
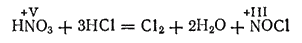
Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
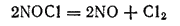
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям:
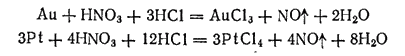
- 401 -
С избытком соляной кислоты хлорид золота (III) и хлорид платины (IV) образуют комплексные соединения H[AuCl4] и H2[PtCl6] .
На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами — NO2. Этот процесс называется нитрованием и имеет большое значение в органической химии.
Электронная структура молекулы HNO3 рассмотрена в § 44.
Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
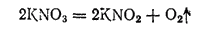
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксид азота. Например:
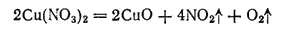
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
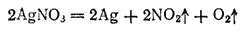
Легко отщепляя кислород, нитраты при высокой температуре являются энергичными окислителями. Их водные растворы, напротив, почти не проявляют окислительных свойств.
Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами.
Нитрат натрия NaNO3, или натриевая селитра, иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили.
Нитрат калия KNO3, или калийная селитра, в небольших количествах также встречается в природе, но главным образом получается искусственно при взаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов.
- 402 -
Нитрат кальция Ca(NO3)2, или кальциевая селитра, получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение.
Нитрат аммония NH4NO3 — см. стр. 390.
| <<< Назад 141. Азотистая кислота. |
Вперед >>> 143. Промышленное получение азотной кислоты. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- Яблочная кислота полезна для здоровья
- 3.32. «ДРЕВЕСНАЯ КИСЛОТА». «КРИМИНАЛЬНОЕ» ПРОИСХОЖДЕНИЕ БЕНЗОЛЬНОГО КОЛЬЦА
- 3.28. КАК ПОЯВИЛОСЬ НАЗВАНИЕ «ЛИМОННАЯ КИСЛОТА»
- 3.30. ЕСТЬ ЛИ В ЯБЛОКАХ ЯБЛОЧНАЯ КИСЛОТА, А В ВИНЕ — ВИННАЯ?
- 5.50. ЧТО ТАКОЕ КРАСНАЯ АЗОТНАЯ КИСЛОТА?
- 6.52. ОПАСНАЯ КИСЛОТА
- 5.13. ЧЕМ ДЫМИТ «ДЫМЯЩАЯ СЕРНАЯ КИСЛОТА»?
- 5.60. МОЖЕТ ЛИ КИСЛОТА ГОРЕТЬ?
- 9.45. МЕЛЛИТОВАЯ КИСЛОТА
- 132. Пероксодвусерная кислота.
- 155. Диоксид углерода. Угольная кислота.
- 133. Тиосерная кислота.
