Книга: Общая химия
147. Оксиды и кислоты фосфора.
| <<< Назад 146. Соединения фосфора с водородом и галогенами. |
Вперед >>> 148. Минеральные удобрения. |
147. Оксиды и кислоты фосфора.
К важнейшим оксидам фосфора принадлежат P2O3 и P2O5.
Оксид фосфора(III), или фосфористый ангидрид, P2O3 получается при медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Это белые кристаллы, плавящиеся при 23б8°C. Молекулярная масса его при низких температурах соответствует формуле P4O6. При действии холодной воды оксид фосфора(III) медленно взаимодействует с ней, образуя фосфористую кислоту H3PO3. Как оксид фосфора(III), так и фосфористая кислота обладают сильно выраженными восстановительными свойствами.
Оксид фосфора(V), или фосфорный ангидрид, P2O5 образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы. Плотность его пара соответствует формуле P4O10.
Оксид фосфора(V) жадно соединяется с водой и потому применяется как очень сильное водоотнимающее средство. На воздухе оксид фосфора(V), притягивая влагу, быстро превращается в расплывающуюся массу метафосфорной кислоты.
Фосфорные кислоты. Оксиду фосфора(V) отвечает несколько кислот. Важнейшая из них — это ортофосфорная кислота H3PO4, называемая обычно просто фосфорной. Другие фосфорные кислоты представляют собою полимерные соединения. В анионе всех фосфорных кислот атом фосфора, находящийся в состоянии sp3-гибридизации, окружен четырьмя атомами кислорода, расположенными в вершинах тетраэдра. Ортофосфорная кислота построена из изолированных тетраэдров, в других фосфорных кислотах тетраэдры PO4 объединены через атомы кислорода в агрегаты, содержащие от двух до весьма большого числа — порядка 105 - атомов фосфора.
Ортофосфорная кислота H3PO4 образует бесцветные прозрачные кристаллы, плавящиеся при 42,35°C. В воде она растворяется очень хорошо.
Ортофосфорная кислота не принадлежит к числу сильных кислот. Константы ее диссоциации равны: K1=8·10-3, K2=6·10-8, K3=10-12. Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют ортофосфатами или просто фосфатами, кислые — гидрофосфатами:

- 408 -
Дигидрофосфаты растворимы в воде; из гидрофосфатов и средних фосфатов хорошо растворимы лишь соли щелочных металлов и аммония.
В водных растворах фосфаты гидролизуются. При этом растворы средних солей щелочных металлов имеют сильно щелочную реакцию. Например, pH 1% раствора Na3PO4 равен 12,1. В случае кислых солей гидролиз сопровождается диссоциацией кислотного остатка (см. § 92). Поэтому растворы гидрофосфатов щелочных металлов имеют слабо щелочную реакцию, а растворы дигидрофосфатов этих металлов — слабокислую. Например, pH 1% раствора Na2HPO4 равен 8,9 а NaH2PO4 - 6,4.
В лаборатории фосфорную кислоту можно получать окислением фосфора 30%-ной HNO3. Реакция протекает согласно уравнению;
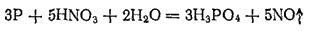
В промышленности фосфорную кислоту получают двумя методами; экстракционным и термическим. В основе экстракционного метода лежит обработка природных фосфатов серной кислотой:

Образующуюся фосфорную кислоту отфильтровывают от сульфата кальция и концентрируют выпариванием. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием и растворением образующегося фосфорного ангидрида в воде. Получаемая по этому методу термическая фосфорная кислота отличается более высокой чистотой и повышенной концентрацией.
Помимо производства удобрений (см. § 148), фосфорную кислоту используют при изготовлении реактивов, многих органических веществ, для создания защитных покрытий на металлах. Фосфаты кальция и аммония применяются при производстве эмалей, в фармацевтической промышленности.
Все другие фосфорные кислоты представляют собой продукты соединения тетраэдров PO4. В большинстве своем эти кислоты не выделены в свободном состоянии, а известны в виде смесей, в водных растворах или в виде солей. В зависимости от способа соединения групп PO4 в фосфатные комплексы эти кислоты разделяются на полифосфорные и метафосфорные кислоты. Полифосфорные кислоты и их соли — полифосфаты — построены из цепочек -PO3-O-PO3-. В метафосфорных кислотах и их солях - метафосфатах — тетраэдры PO4 образуют кольца.
Из полифосфорных кислот в кристаллическом состоянии выделена только простейшая двуфосфорная (или пирофосфорная) кислота H4P2O7, образующая бесцветные кристаллы, плавящиеся при 61°C. Ион P2O74- построен из двух тетраэдров PO4 с общим атомом кислорода.
- 409 -
Структурная формула двуфосфорной кислоты:

Двуфосфорная кислота хорошо растворяется в воде и является несколько более сильной кислотой, чем H3PO4 (K1 = 1,4·10-1, K2 = 10-2, K3 = 2·10-7, K4 = 4·10-10). Ее соли называются дифосфатами, или пирофосфатами.
Метафосфорные кислоты имеют общую формулу HnPnO3n, где n может принимать значения от 3 до 8; однако часто их состав выражают простейшей формулой HPO3. Эти кислоты представляют собою стеклообразные вещества. В раствор они переходят в виде полимеров, имеющих кольцевую структуру. С течением времени кольца расщепляются и образуются цепные полифосфорные кислоты. Метафосфорные кислоты, ядовиты. Известны соли метафосфорных кислот — мета фосфаты. Некоторые из них выделены в виде кристаллов, например Na3P3O9, Na4P4O12, Ca3(P3O9)2. Метафосфаты применяются для умягчения воды и снижения ее коррозионной активности, для удаления накипи с паровых котлов, а также входят в состав некоторых моющих средств.
| <<< Назад 146. Соединения фосфора с водородом и галогенами. |
Вперед >>> 148. Минеральные удобрения. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- Бактерии, вырабатывающие аминокислоты
- 9. Органические вещества. Нуклеиновые кислоты
- 2.3.4.Нуклеиновые кислоты
- § 52 Строение и свойства неорганических веществ. Кислоты и основания
- Сложные неорганические вещества: кислоты и основания.
- 2.6. Органические вещества. Нуклеиновые кислоты
- Органические кислоты
- Нуклеиновые кислоты
- § 57 Соединения, необходимые для существования жизни: нуклеиновые кислоты, полисахариды
- 3.1. Аминокислоты
- Оживление литосферы
