Книга: Общая химия
138. Фиксация атмосферного азота. Получение аммиака.
| <<< Назад 137. Аммиак. Соли аммония. |
Вперед >>> 139. Гидразин. Гидроксиламин. Азидоводород. |
138. Фиксация атмосферного азота. Получение аммиака.
До конца прошлого столетия аммиак получался в промышленном масштабе исключительно как побочный продукт при коксовании каменного угля. Каменный уголь содержит от 1 до 2% азота. При сухой перегонке угля почти весь этот азот выделяется в виде аммиака и солей аммония. Отделение аммиака и солей аммония от других газообразных продуктов сухой перегонки достигается пропусканием коксового газа через воду. Из этой аммиачной или, как ее называют, газовой воды аммиак выделяется при нагревании с известью.
Долгое время газовая вода служила единственным источником получения аммиака. Но в начале XX века были разработаны новые промышленные способы получения аммиака, основанные на связывании или, как говорят, фиксации атмосферного азота. Чтобы оценить, какое огромное значение для человечества имели эти открытия, нужно ясно представить себе роль азота в жизненных процессах.
Как мы уже говорили, азот — обязательная составная часть белков; он необходим для питания всякого живого существа. Однако, несмотря на огромные, практически неисчерпаемые запасы свободного азота в атмосфере, ни животные, ни растения (за небольшими исключениями) не могут непосредственно пользоваться этим азотом для питания.
- 391 -
Растения берут азот из почвы, где он содержится главным образом в виде различных органических соединений, которые постепенно превращаются в соли азотной кислоты и соли аммония. Растворяясь во влаге почвы, эти соли поглощаются корнями растений, а затем перерабатываются в их клетках в белки.
Животные не могут усваивать азот даже в виде солей. Для питания им необходимы белки, вырабатываемые растениями или другими животными. Поэтому существование животных находится в полной зависимости от растений; только при посредстве растений они могут получать необходимый им азот.
Почва обычно содержит очень незначительные количества азота, который все время извлекается из нее растениями. При уборке с полей урожая уносится и извлеченный растениями из почвы азот. Таким образом, почва истощается и становится все менее и менее плодородной. Поэтому для получения хороших урожаев необходимо постоянно пополнять убыль азота в почве путем введения в нее различных азотных удобрений.
До начала первой мировой войны 1914—1918 гг. главным минеральным азотным удобрением служила натриевая (чилийская) селитра, ввозившаяся в Европу из Южной Америки. Она же являлась единственным видом сырья для получения азотной кислоты, необходимой в производстве взрывчатых веществ и других соединений азота. Ограниченность запасов природной селитры, их отдаленность от основных потребителей, а главным образом — стремление освободиться от ввоза сырья выдвинули перед химической промышленностью многих стран задачу использования атмосферного азота для получения азотных соединений. Успешное решение этой задачи явилось одним из крупнейших завоеваний химии начала XX века. В течение одного десятилетня были открыты несколько технических способов фиксации азота воздуха.
Первым по времени открытия (1904 г.) является цианамидный способ получения аммиака, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция CaC2, образуя цианамид кальция* CaCN2:

Цианамид кальция — порошок, окрашенный в темно-серый цвет примесью угля. При действии на него водяного пара под давлением около 0,6 МПа он легко разлагается с образованием аммиака и карбоната кальция:
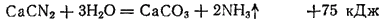
* Цианамид кальция Ca=N-C?N можно рассматривать как производное цианамида H2N-CN.
- 392 -
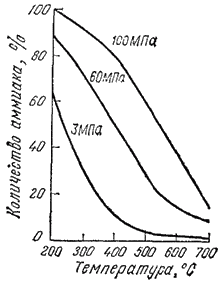
Рис. 115. Зависимость выхода аммиака от температуры при различных давлениях.
Первый завод для получения цианамида кальция мощностью 4 тыс. т в год был построен в 1906 г. в Италии. В 1921 г. мировое производство цианамида кальция достигло 500 тыс. т в год. Но затем строительство новых заводов почти прекратилось, так как преобладающее значение получил другой метод промышленного производства аммиака — синтез аммиака из водорода и азота.
При комнатной температуре азот не взаимодействует с водородом. Но уже давно было известно, что если пропускать через смесь этих газов электрические искры, то образуется некоторое количество аммиака. Подробное изучение этой реакции показало, что реакция между азотом и водородом обратима:
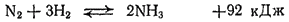
При высокой температуре, создаваемой электрическими разрядами, равновесие сильно сдвинуто влево — количество получающегося аммиака очень мало. Все попытки увеличить его долгое время кончались неудачей. Только в начале XX века удалось, наконец, найти условия, при которых выход аммиака становится достаточным для проведения процесса в заводском масштабе. Оказалось, что этими условиями являются высокое давление и низкая температура (см. § 64).
Но при низких температурах скорость реакции настолько мала, что потребовалось бы слишком много времени для получения значительных количеств аммиака. Ускорения процесса удалось добиться применением катализаторов. Из различных исследованных веществ наилучшим оказалось определенным образом приготовленное пористое железо, содержащее небольшие количества оксидов алюминия, калия, кальция и кремния.
Реакцию ведут при температуре около 500°C, компенсируя вызываемый этим сдвиг равновесия влево повышенным давлением. Рис. 115 показывает, как изменяется содержание аммиака при достижении равновесия в системе в зависимости от температуры и давления.
- 393 -
Нетрудно убедиться, что один и тот же выход аммиака может быть получен как при сравнительно низкой, так и при более высокой температуре, если в последнем случае увеличить давление. Но при повышении температуры возрастает скорость реакции и нужное количество аммиака получается за более короткое время.
При осуществлении синтеза аммиака на железном катализаторе первая стадия реакции представляет собой адсорбцию железом молекул водорода и азота. Молекулы водорода при этом диссоциируют на атомы, а молекулы азота делаются менее прочными — часть связей в них разрывается. Далее реакция протекает приблизительно по такой схеме:
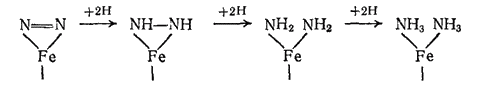
Образующиеся на поверхности катализатора молекулы аммиака вытесняются молекулами азота, и превращение повторяется.
Все промышленные установки синтеза аммиака работают с использованием принципа циркуляции: после реакции смесь газов охлаждается, содержащийся в ней аммиак конденсируется и отделяется, а непрореагировавшие азот и водород смешиваются со свежей порцией газов, снова подаются на катализатор и т. д. Применение циркуляции увеличивает производительность всей системы.
Синтез аммиака можно проводить при различных давлениях от 15 до 100 МПа. Наибольшее распространение получили системы, работающие при среднем давлении (30 МПа); в экономическом отношении они наиболее целесообразны.
В настоящее время синтез аммиака является основным способом связывания атмосферного азота.
| <<< Назад 137. Аммиак. Соли аммония. |
Вперед >>> 139. Гидразин. Гидроксиламин. Азидоводород. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- 3.6. Особенности атмосферного движения и распада выбросов
- Получение и использование синтетических полимеров
- Глава 7 Получение нуклеотидов из продуктов атмосферной фотохимии
- Получение нуклеотидов
- Глава 21 По ту сторону физики Получение знания, имеющего смысл, но неизмеримого экспериментально…
- Получение кристаллов с определенными свойствами
- Получение кристаллов с заданным химическим составом
- Получение кристаллов заданной формы
- Получение крупногабаритных кристаллов
- 8.35. ПОЛУЧЕНИЕ ФЕНОЛА — НЕЛЕГКАЯ ЗАДАЧА
- 143. Промышленное получение азотной кислоты.
- 197. Щелочные металлы в природе. Получение и свойства щелочных металлов.
