Книга: Общая химия
140. Оксиды азота.
| <<< Назад 139. Гидразин. Гидроксиламин. Азидоводород. |
Вперед >>> 141. Азотистая кислота. |
140. Оксиды азота.
Азот образует с кислородом ряд оксидов; все они могут быть получены из азотной кислоты или ее солей.
Оксид азота (I), или закись азота, N2O получается при нагревании нитрата аммония:
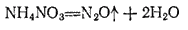
Оксид азота (I) представляет собою бесцветный газ со слабым запахом и сладковатым вкусом. Он мало растворим в воде: один объем воды при 20°C растворяет 0,63 объема N2O.
Оксид азота (I) - термодинамически неустойчивое соединение. Стандартная энергия Гиббса его образования положительна (?G°обр=104 кДж/моль). Однако вследствие большой прочности связей в молекуле N2O энергии активации реакций, протекающих с участием этого вещества, высоки. В частности, высока энергия активации распада N2O. Поэтому при комнатной температуре оксид азота (I) устойчив. Однако при повышенных температурах он разлагается на азот и кислород; разложение идет тем быстрее, чем выше температура.
Ни с водой, ни с кислотами, ни со щелочью оксид азота (I) не реагирует.
Электронная структура молекулы N2O рассмотрена в § 41.
Вдыхание небольших количеств оксида азота (I) приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза.
- 395 -
Большие количества оксида азота (I) действуют на нервную систему возбуждающе; поэтому раньше его называли «веселящим газом».
Оксид азота(II), или окись азота, NO представляет собой бесцветный трудно сжижаемый газ. Жидкий оксид азота (II) кипит при NO и затвердевает при -151,7°C. В воде он мало растворим: 1 объем воды растворяет при 0°C всего 0,07 объема NO.
По химическим свойствам оксид азота (II) относится к числу безразличных оксидов, так как не образует никакой кислоты.
Подобно N2O оксид азота (II) термодинамически неустойчив - стандартная энергия Гиббса его образования положительна (?G°обр=86,6 кДж/моль). Но, опять-таки подобно N2O, при комнатной температуре NO не разлагается, потому что его молекулы достаточно прочны. Лишь при температурах выше 1000°C его распад на азот и кислород начинает протекать с заметной скоростью. При очень высоких температурах, по причинам, рассмотренным в § 65, распад NO проходит не до конца — в системе NO-N2-O2 устанавливается равновесие. Благодаря этому оксид азота (II) можно получить из простых веществ при температурах электрической дуги (3000-4000°C).
В лаборатории оксид азота (II) обычно получают взаимодействием 30—35%-ной азотной кислоты с медью:
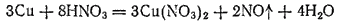
В промышленности он является промежуточным продуктом при производстве азотной кислоты (см. § 143).
Для оксида азота (II) характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей — восстанавливается. Например, он легко окисляется кислородом воздуха до диоксида азота:
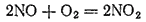
В то же время смесь равных объемов NO и H2 при нагревании взрывает:
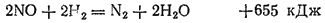
Электронная структура молекулы NO лучше всего описывается методом МО. На рис. 116 представлена схема заполнения МО в молекуле NO. с аналогичными схемами для молекул N2 и СО — рис. 51 и 53 на стр. 142 и 143). Молекула NO имеет на один электрон больше, чем молекулы N2 и СО: этот электрон находится на разрыхляющей орбитали ?разр2p. Таким образом, число связывающих электронов превышает здесь число разрыхляющих на пять. Это соответствует кратности связи 2,5 (5:2 = 2,5). Действительно, энергия диссоциации молекулы NO на атомы (632 кДж/моль) имеет промежуточное значение по сравнению с соответствующими величинами для молекулы O2 (498 кДж/моль), в которой кратность связи равна двум, и молекулы N2 (945 кДж/моль), где связь тройная.
- 396 -
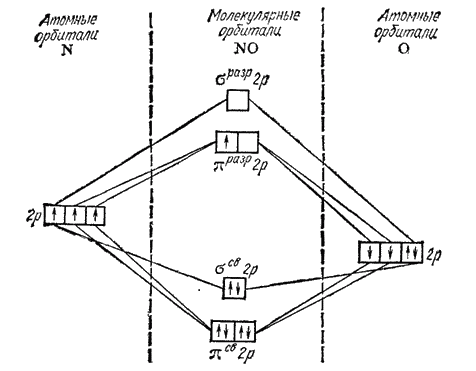
Рис. 116. Энергетическая схема образования молекулы NO.
Вместе с тем, по энергии диссоциации молекула NO близка к молекулярному иону кислорода O2+ (644 кДж/моль), в котором кратность связи также равна 2,5 (см. стр. 142).
При отрыве от молекулы NO одного электрона образуется NO+, не содержащий разрыхляющих электронов; кратность связи между атомами возрастает при этом до трех (шесть связывающих электронов). Поэтому энергия диссоциации иона NO+ (1050 кДж/моль) выше энергии диссоциации молекулы NO и близка к соответствующей величине для молекулы СО (1076 кДж/моль), в которой кратность связи равна трем.
Диоксид (или двуокись) азота NO2 — бурый ядовитый газ, обладающий характерным запахом. Он легко сгущается в красноватую жидкость (темп. кип. 21°C), которая при охлаждении постепенно светлеет и при -11.2°C замерзает, образуя бесцветную кристаллическую массу. При нагревании газообразного диоксида азота его окраска, наоборот, усиливается, а при 140°C становится почти черной. Изменение окраски диоксида азота при повышении температуры сопровождается и изменением его молекулярной массы. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N2O4. С повышением температуры плотность пара уменьшается и при 140°C соответствует формуле NO2. Бесцветные кристаллы, существующие при —11,2°C и ниже, состоят из молекул N2O4. По мере нагревания молекулы NO2 диссоциируют с образованием молекул темно-бурого диоксида азота; полная диссоциация происходит при 140°C.
- 397 -
Таким образом, при температурах от —11,2 до 140°C молекулы NO2 и N2O4 находятся в равновесии друг с другом:
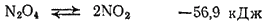
Выше 140°C начинается диссоциация NO2 на NO и кислород.
Диоксид азота — очень энергичный окислитель. Многие вещества могут гореть в атмосфере NO2, отнимая от него кислород. Диоксид серы окисляется им в триоксид, на чем основан нитрозный метод получения серной кислоты (см. § 131).
Пары NO2 ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде NO2 вступает в реакцию с водой, образуя азотную и азотистую кислоты.
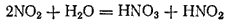
Поэтому диоксид азота можно считать смешанным ангидридом этих кислот.
Но азотистая кислота очень нестойка и быстро разлагается:
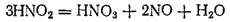
Поэтому практически взаимодействие диоксида азота с водой особенно с горячей, идет согласно уравнению
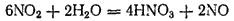
которое можно получить сложением двух предыдущих уравнений, если предварительно первое из них умножить на три.
В присутствии воздуха образующийся оксид азота немедленно окисляется в диоксид азота, так что в этом случае NO2 в конечном итоге полностью переходит в азотную кислоту:
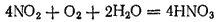
Эта реакция используется в современных способах получения азотной кислоты.
Если растворять диоксид азота в щелочах, то образуется смесь солей азотной и азотистой кислот, например:
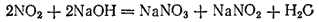
Оксид азота(III), или азотистый ангидрид, N2O3 представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на NO и NO2. Смесь равных объемов NO и NO2 при охлаждении вновь образует N2O3:
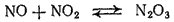
Оксиду азота(III) соответствует азотистая кислота HNO2.
Оксид азота (V), или азотный ангидрид, N2O5 белые кристаллы, уже при комнатной температуре постепенно разлагающиеся на NO2 и O2.
- 398 -
Он может быть получен действием фосфорного ангидрида на азотную кислоту:
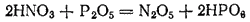
Оксид азота(V) — очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются. В воде оксид азота(V) хорошо растворяется с образованием азотной кислоты.
В твердом состоянии N2O5 образован нитратным ионом NO3- и ионом нитрония NO2+. Последний содержит такое же число электронов, что и молекула CO2 и, подобно последней, имеет линейное строение: O=N+=O. В парах молекула N2O5 симметрична; ее строение может быть представлено следующей валентной схемой, в которой пунктиром показаны трехцентровые связи (ср. с валентной схемой молекулы азотной кислоты на стр. 134):
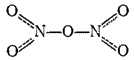
| <<< Назад 139. Гидразин. Гидроксиламин. Азидоводород. |
Вперед >>> 141. Азотистая кислота. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- Межклеточное вещество
- 04. На что влияет нагрев планет звездами, звезд Ядрами Галактик, Ядер Галактик Ядрами Сверхгалактик
- Список литературы
- Разные человечества
- Красные тучи, закрывающие солнце
- Московская белая
- Муравей, семья, колония
- Примерные рационы для котят от месяца до пяти и старше
- Голосеменные растения завоевывают мир
- Пароль скрещенных антенн
- Позор страны
- Что такое водопад?
