Книга: Общая химия
146. Соединения фосфора с водородом и галогенами.
| <<< Назад ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора. |
Вперед >>> 147. Оксиды и кислоты фосфора. |
146. Соединения фосфора с водородом и галогенами.
С водородом фосфор образует газообразный фосфористый водород, или фосфин, PH3. Его можно получить кипячением белого фосфора с раствором щелочи или действием соляной кислоты на фосфид кальция Ca3P2:
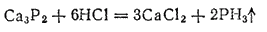
Фосфин — бесцветный газ с чесночным запахом, очень ядовитый. При его горении образуются фосфорный ангидрид и вода:
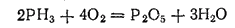
Основные свойства выражены у фосфина слабее, чем у аммиака. Он образует соли только с наиболее сильными кислотами, например PClO4, HCl. В этих солях катионом является ион фосфония PH4+. Примером может служить хлорид фосфония PH4Cl. Соли фосфония — очень непрочные соединения; при взаимодействии с водой они разлагаются на галогеноводород и фосфин.
Фосфор непосредственно соединяется со всеми галогенами с выделением большого количества теплоты. Практическое значение имеют главным образом соединения фосфора с хлором.
Хлорид фосфора(III), или треххлористый фосфор, PCl3 получается при пропускании хлора над расплавленным фосфором. Он представляет собой жидкость, кипящую при 75°C.
При действии воды PCl3 полностью гидролизуется с образованием хлороводорода и фосфористой кислоты H3PO3:
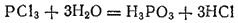
При пропускании хлора в треххлористый фосфор получается хлорид фосфора(V), или пятихлористый фосфор, PCl5, который при обычных условиях образует твердую белую массу. Пятихлористый фосфор тоже разлагается водой с образованием хлороводорода и фосфорной кислоты. Аналогичные соединения фосфор образует с бромом, иодом и фтором; однако для иода соединение состава PI5 неизвестно.
- 407 -
Хлориды фосфора применяются при синтезах различных органических веществ.
| <<< Назад ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора. |
Вперед >>> 147. Оксиды и кислоты фосфора. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- 147. Оксиды и кислоты фосфора.
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- 157. Соединения углерода с серой и азотом.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 179. Соединения кремния с водородом и галогенами.
- § 58 Соединения, необходимые для существования жизни: белки, липиды
- § 56 Высокомолекулярные соединения
- § 57 Соединения, необходимые для существования жизни: нуклеиновые кислоты, полисахариды
- § 55 Циклические органические соединения
- Органические соединения в космосе
- 910. Почему не следует сбрасывать в океан азотистые и фосфатные соединения, а также органические вещества?
- 3.2. Комплексные соединения и живое вещество
