Книга: Общая химия
137. Аммиак. Соли аммония.
| <<< Назад АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота. |
Вперед >>> 138. Фиксация атмосферного азота. Получение аммиака. |
137. Аммиак. Соли аммония.
Азот образует несколько соединений с водородом; из них наибольшее значение имеет аммиак — бесцветный газ с характерным резким запахом (запах «нашатырного спирта»).
В лаборатории аммиак обычно получают, нагревая хлорид аммония NH4Cl с гашеной известью Ca(OH)2. Реакция выражается уравнением

Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
- 386 -
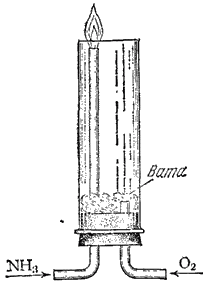
Рис. 114. Прибор для демонстрации горения аммиака в кислороде.
Масса 1 л аммиака при нормальных условиях равна 0,77 г. Поскольку этот газ значительно легче воздуха, то его можно собирать в перевернутые вверх дном сосуды.
При охлаждении до -33.4°C аммиак под обычным давлением превращается в прозрачную жидкость, затвердевающую при -77.8°C.
Электронная структура и пространственное строение молекулы аммиака рассмотрены в § 43. В жидком аммиаке молекулы NH3(?=1.48D) связаны между собой водородными связями, что обусловливает сравнительно высокую температуру кипения аммиака (-33,4°C), не соответствующую его малой молекулярной массе (17).
Аммиак очень хорошо растворим в воде: 1 объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25% (масс.) NH3 и имеет плотность 0,91 г/см3. Раствор аммиака в воде иногда называют нашатырным спиртом. Обычный медицинский нашатырный спирт содержит 10% NH3. С повышением температуры, растворимость аммиака уменьшается, поэтому он выделяется при нагревании из концентрированного раствора, чем иногда пользуются в лабораториях для получения небольших количеств газообразного аммиака.
При низкой температуре из раствора аммиака может быть выделен кристаллогидрат NH3·H2O, плавящийся при — -79°C. Известен также кристаллогидрат состава 2NH3·H2O. В этих гидратах молекулы воды и аммиака соединены между собой водородными связями.
В химическом отношении аммиак довольно активен; он вступает во взаимодействие со многими веществами. В аммиаке азот имеет самую низкую степень окисленности (-3). Поэтому аммиак обладает только восстановительными свойствами. Если пропускать ток NH3 по трубке, вставленной в другую широкую трубку (рис. 114), по которой проходит кислород, то аммиак можно легко зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется вода и свободный азот:
4NH3 + 3O2 = 6H2O + 2N2
При других условиях аммиак может окисляться до оксида азота NO (см. § 143).
В отличие от водородных соединений неметаллов VI и VII групп, аммиак не обладает кислотными свойствами. Однако атомы водорода в его молекуле могут замещаться атомами металлов.
- 387 -
При полном замещении водорода металлом образуются соединения, называемые нитридами. Некоторые из них, например нитриды кальция и магния, получаются при непосредственном взаимодействии азота с металлами при высокой температуре;
3Mg + N2 = Mg3N2
При соприкосновении с водой многие нитриды полностью гидролизуются с образованием аммиака и гидроксида металла. Например:
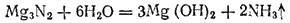
При замещении в молекулах аммиака только одного атома водорода металлами образуются амиды металлов. Так, пропуская аммиак над расплавленным натрием, можно получить амид натрия NaNH2 в виде бесцветных кристаллов:
2NH6 + 2Na = 2NaNH2 + H2
Вода разлагает амид натрия;
NaNH2 + H2O = NaOH + NH3?
Обладая сильными основными и водоотнимающими свойствами, амид натрия нашел применение при некоторых органических синтезах, например, в производстве красителя индиго и некоторых лекарственных препаратов.
Водород в аммиаке может замещаться также галогенами. Так, при действии хлора на концентрированный раствор хлорида аммония получается нитрид хлора, или хлористый азот, NCl3
NH4Cl + 3Cl2 = NCl3 + 4HCl
в виде тяжелой маслянистой взрывчатой жидкости.
Подобными же свойствами обладает нитрид иода (иодистый азот), образующийся в виде черного, нерастворимого в воде порошка при действии иода на аммиак. Во влажном состоянии он безопасен, но высушенный взрывается от малейшего прикосновения; при этом выделяются пары иода фиолетового цвета.
С фтором азот образует устойчивый фторид азота NF3.
Из данных табл. 6 (стр. 118) видно, что электроотрицательность хлора и пода меньше, а фтора больше, чем электроотрицательность азота. Отсюда следует, что в соединениях NCl3 и NI3 степень окисленности азота равна —3, а в NF3 она равна +3. Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, при взаимодействии с водою NCl3 или NI3 образуется аммиак, а в случае NF3 получается оксид азота (III);
NCl3 + 3H2O = NH3 + 3HOCl
2NF3 + 3H2O = N2O3 + 6HF
Атом азота в молекуле аммиака связан тремя ковалентными связями с атомами водорода и сохраняет при этом одну неподеленную электронную пару:
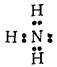
Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно-акцепторному способу четвертой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами.
- 388 -
Этим объясняется чрезвычайно характерная для аммиака способность вступать в реакции присоединения.
Примеры сложных (комплексных) соединений, образуемых аммиаком в результате реакций присоединения, приведены в §§ 200 и 201, а также в гл. XVIII. Выше (стр. 124) уже было рассмотрено взаимодействие молекулы NH3 с ионом водорода, приводящее к образованию иона аммония NH4+:
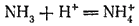
В этой реакции аммиак служит акцептором протона и, следовательно, с точки зрения протонной теории кислот и оснований (стр. 237) проявляет свойства основания. Действительно, реагируя с кислотами, находящимися в свободном состоянии или в растворе, аммиак нейтрализует их, образуя соли аммония. Например, с соляной кислотой получается хлорид аммония NH4Cl:
NH3 + HCl = NH4Cl
Взаимодействие аммиака с водой тоже приводит к образованию не только гидратов аммиака, но частично и иона аммония:
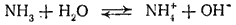
В результате концентрация ионов OH- в растворе возрастает. Именно поэтому водные растворы аммиака обладают щелочной реакцией. Однако по установившейся традиции водный раствор аммиака обычно обозначают формулой NH4OH и называют гидроксидом аммония, а щелочную реакцию этого раствора рассматривают как результат диссоциации молекул NH4OH.
Аммиак — слабое основание. При 18°C константа равновесия его ионизации (см. предыдущее уравнение) равна 1.8·10-5 . В 1 л одномолярного водного раствора аммиака содержится всего лишь 0,0042 эквивалента ионов OH- и NH4+; такой раствор при 18°C имеет pH 11.77.
Большинство солей аммония бесцветны и хорошо растворимы в воде. По некоторым своим свойствам они подобны солям щелочных металлов, особенно калия (ионы K+ и NH4+ имеют близкие размеры).
Поскольку водный раствор аммиака представляет собой слабое основание, то соли аммония в растворах гидролизуются. Растворы солей, образованных аммиаком и сильными кислотами, имеют слабокислую реакцию.
Гидролиз иона аммония обычно записывают в такой форме:
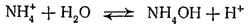
Однако правильнее рассматривать его как обратимый переход протона от иона аммония к молекуле воды:
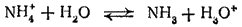
- 389 -
При добавлении щелочи к водному раствору какой-либо соли аммония ионы H3O+ связываются ионами ОН- в молекулы воды и равновесие гидролиза смещается вправо. Происходящий при этом процесс можно выразить уравнением:
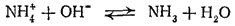
При нагревании раствора аммиак улетучивается, в чем нетрудно убедиться по запаху. Таким образом, присутствие любой аммонийной соли в растворе можно обнаружить, нагревая раствор со щелочью (реакция на ион аммония).
Соли аммония термически неустойчивы. При нагревании они разлагаются. Это разложение может происходить обратимо или необратимо. Соли аммония, анион которых не является окислителем или лишь в слабой степени проявляет окислительные свойства, распадаются обратимо. Например, при нагревании хлорид аммония как бы возгоняется — разлагается на аммиак и хлороводород, которые на холодных частях сосуда вновь соединяются в хлорид аммония:
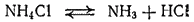
При обратимом распаде солей аммония, образованных нелетучими кислотами, улетучивается только аммиак. Однако продукты разложения — аммиак и кислота, — будучи смешаны, вновь соединяются друг с другом. Примерами могут служить реакции распада сульфата аммония (NH4)2SO4 или фосфата аммония (NH4)3PO4.
Соли аммония, анион которых проявляет более резко выраженные окислительные свойства, распадаются необратимо: протекает окислительно-восстановительная реакция, в ходе которой ион аммония окисляется, а анион восстанавливается. Примерами могут служить распад NH4NO2 (§ 136) или разложение нитрата аммония:
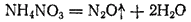
Аммиак и соли аммония находят широкое применение. Как уже говорилось, аммиак даже при невысоком давлении (0,7-0,8 МПа) легко превращается в жидкость. Поскольку при испарении жидкого аммиака поглощается большое количество теплоты (1,37 кДж/г), то жидкий аммиак используется в различных холодильных устройствах.
Водные растворы аммиака применяются в химических лабораториях и производствах как слабое легколетучее основание; их используют также в медицине и в быту. Но большая часть получаемого в промышленности аммиака идет на приготовление азотной кислоты, а также других азотсодержащих веществ. К важнейшим из них относятся азотные удобрения, прежде всего сульфат и нитрат аммония и карбамид (стр. 427).
Сульфат аммония (NH4)2SO4 служит хорошим удобрением и производится в больших количествах.
- 390 -
Нитрат аммония NH4NO3 тоже применяется в качестве удобрения; процентное содержание усвояемого азота в этой соли выше, чем в других нитратах или солях аммония. Кроме того, нитрат аммония образует взрывчатые смеси с горючими веществами (аммоналы), применяемые для взрывных работ.
Хлорид аммония, или нашатырь, NH4Cl применяется в красильном деле, в ситцепечатании, при паянии и лужении, а также в гальванических элементах. Применение хлорида аммония при паянии основано на том, что он способствует удалению с поверхности металла оксидных пленок, благодаря чему припой хорошо пристает к металлу. При соприкосновении сильно нагретого металла с хлоридом аммония оксиды, находящиеся на поверхности металла, либо восстанавливаются, либо переходят в хлориды. Последние, будучи более летучи, чем оксиды, удаляются с поверхности металла. Для случая меди и железа основные происходящие при этом процессы можно выразить такими уравнениями:
4CuO + 2NH4Cl = 3Cu + CuCl2 + N2 + 4H2O
Fe3O4 + 8NH4Cl = FeCl2 + 2FeCl3+ 8NH3 + 4H2O
Первая из этих реакций является окислительно-восстановительной: медь, будучи менее активным металлом, чем железо, восстанавливается аммиаком, который образуется при нагревании NH4Cl.
Жидкий аммиак и насыщенные им растворы аммонийных солей применяют в качестве удобрений. Одним из главных преимуществ таких удобрений является повышенное содержание в них азота.
| <<< Назад АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота. |
Вперед >>> 138. Фиксация атмосферного азота. Получение аммиака. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- 138. Фиксация атмосферного азота. Получение аммиака.
- 5.45. СУЩЕСТВУЕТ ЛИ АМАЛЬГАМА АММОНИЯ?
- Облачный покров и прилегающие слои атмосферы
- 9. Как зародилась жизнь
- 147. Оксиды и кислоты фосфора.
- 97. Окислительно-восстановительная двойственность.
- 155. Диоксид углерода. Угольная кислота.
- 187. Олово (Stannuin).
- 142. Азотная кислота.
- 140. Оксиды азота.
- Анализ и синтез
