Книга: Общая химия
141. Азотистая кислота.
| <<< Назад 140. Оксиды азота. |
Вперед >>> 142. Азотная кислота. |
141. Азотистая кислота.
Если нагревать нитрат калия или натрия, то они теряют часть кислорода и переходят в соли азотистой кислоты HNO2. Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
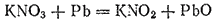
Соли азотистой кислоты — нитриты — образуют кристаллы, хорошо растворимые в воде (за исключением нитрита серебра). Нитрит натрия NaNO2 применяется при производстве различных красителей.
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
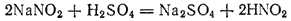
Она принадлежит к числу слабых кислот (K = 4·10-4 ) и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
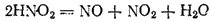
Степень окисленности азота в азотистой кислоте равна +3, т. е. является промежуточной между низшими и высшей из возможных значений степени окисленности азота. Поэтому HNO2 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до NO), а в реакциях с окислителями — окисляется до HNO3. Примерами могут служить следующие реакции:
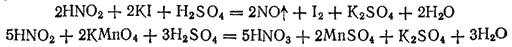
- 399 -
| <<< Назад 140. Оксиды азота. |
Вперед >>> 142. Азотная кислота. |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- 142. Азотная кислота.
- Яблочная кислота полезна для здоровья
- 3.32. «ДРЕВЕСНАЯ КИСЛОТА». «КРИМИНАЛЬНОЕ» ПРОИСХОЖДЕНИЕ БЕНЗОЛЬНОГО КОЛЬЦА
- 3.28. КАК ПОЯВИЛОСЬ НАЗВАНИЕ «ЛИМОННАЯ КИСЛОТА»
- 3.30. ЕСТЬ ЛИ В ЯБЛОКАХ ЯБЛОЧНАЯ КИСЛОТА, А В ВИНЕ — ВИННАЯ?
- 5.50. ЧТО ТАКОЕ КРАСНАЯ АЗОТНАЯ КИСЛОТА?
- 6.52. ОПАСНАЯ КИСЛОТА
- 5.13. ЧЕМ ДЫМИТ «ДЫМЯЩАЯ СЕРНАЯ КИСЛОТА»?
- 5.60. МОЖЕТ ЛИ КИСЛОТА ГОРЕТЬ?
- 9.45. МЕЛЛИТОВАЯ КИСЛОТА
- 132. Пероксодвусерная кислота.
- 155. Диоксид углерода. Угольная кислота.
