Книга: Общая химия
197. Щелочные металлы в природе. Получение и свойства щелочных металлов.
| <<< Назад Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
Вперед >>> 198. Натрий (Natrium). |
197. Щелочные металлы в природе. Получение и свойства щелочных металлов.
Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калий принадлежат к распространенным элементам: содержание каждого из них в земной коре равно приблизительно 2% (масс.). Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлорид натрия содержится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлорида или двойных солей с натрием и магнием. Однако большие скопления солей калия, имеющие промышленное значение, встречаются редко. Наиболее важными из них являются соликамские месторождения в СССР, страссфуртские в ГДР и эльзасские — во Франции. Залежи натриевой селитры находятся в Чили. В воде многих озер содержится сода. Наконец, огромные количества сульфата натрия находятся в заливе Кара-Богас-Гол Каспийского моря, где эта соль в зимние месяцы толстым слоем осаждается на дне.
Значительно меньше, чем натрий и калий, распространены литий, рубидий и цезий. Чаще других встречается литий, но содержащие его минералы редко образуют большие скопления. Рубидий и цезий содержатся в небольших количествах в некоторых литиевых минералах.
Все известные изотопы франция радиоактивны и быстро распадаются. Первым был открыт изотоп 223Fr; его существование было установлено французской исследовательницей М. Пере в 1939 г.
- 545 -
Он образуется при распаде актиния и в ничтожном количестве встречается в природе. В настоящее время небольшие количества франция получают искусственно.
Натрий и литии получают электролизом расплавов их соединений, калий — восстановлением из расплавов КОН или КСl натрием, рубидий и цезий — восстановлением из их хлоридов кальцием.
Все щелочные металлы кристаллизуются в кубической объем-ноцентрированной решетке. Они обладают металлическим блеском, который можно наблюдать на свежем разрезе металла. На воздухе блестящая поверхность металла сейчас же тускнеет вследствие окисления.
Щелочные металлы характеризуются незначительной твердостью, малой плотностью и низкими температурами плавления и кипения. Наименьшую плотность имеет литий, самую низкую температуру плавления — франций (см.табл. 30).
Приведенные в табл. 30 данные показывают, что в большинстве случаев свойства щелочных металлов закономерно изменяются при переходе от лития к цезию. В основе наблюдающихся закономерностей лежит возрастание массы и радиуса атома в подгруппе сверху вниз. Рост массы приводит к возрастанию плотности. Увеличение радиуса обусловливает ослабление сил притяжения между атомами, что объясняет снижение температур плавления и кипения и уменьшение энергии атомизации металлов, а также уменьшение энергии ионизации атомов при переходе от лития к цезию. Однако стандартные электродные потенциалы щелочных металлов изменяются в ряду Li - Cs не так правильно. Причина этого, подробно рассмотренная в § 100, заключается в том, что величины электродных потенциалов связаны с несколькими факторами, различно изменяющимися при переходе от одного элемента подгруппы к другому.
Щелочные металлы принадлежат к числу наиболее активных в химическом отношении элементов. Их высокая химическая активность обусловлена в первую очередь низкими значениями энергии ионизации их атомов — легкостью отдачи ими валентных электронов. При этом энергия ионизации уменьшается при переходе от лития к цезию (табл. 30). Ясно, что химическая активность при этом возрастает.
Все щелочные металлы энергично соединяются с кислородом. Рубидий и цезий самовоспламеняются на воздухе; литий, натрий и калий загораются при небольшом нагревании. Характерно, что только литий, сгорая, образует нормальный оксид Li2O, остальные же щелочные металлы превращаются в пероксидные соединения: Na2O2, KO2, RbO2, CsO2.
Не менее энергично, чем с кислородом, взаимодействуют щелочные металлы с галогенами, особенно с хлором и фтором.
- 546 -
В ряду напряжений щелочные металлы стоят далеко впереди водорода и вытесняют водород из воды; при этом образуются сильные основания, например:
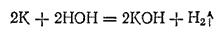
Легко отдавая при химических реакциях свои валентные электроны, щелочные металлы являются самыми энергичными восстановителями. Их восстановительная способность настолько велика, что они могут восстанавливать даже атомы водорода, превращая их в отрицательно заряженные ионы H-. Так, при нагревании щелочных металлов в струе водорода получаются их гидриды, например:
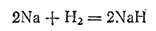
Гидриды щелочных металлов имеют ионное строение. Металл входит в их состав в виде катиона, а водород — в виде аниона.
Большинство солей щелочных металлов хорошо растворимы в воде. Мало растворимы LiF, Li2CO3, Li3PO4, Na[Sb(OH)6], KClO4, K2[PtCl6], Rb[RtCl6], RbClO4 и CsClO4.
Если внести в пламя газовой горелки соль щелочного металла, то она разлагается, и пары освободившегося металла окрашивают пламя в характерный для данного металла цвет. Литий окрашивает пламя в карминово-красный цвет, натрий — в желтый, калий — в фиолетовый. Таким путем можно обнаружить эти элементы в соответствующей пробе.
Щелочные металлы и их соединения широко используются в технике. Литий применяется в ядерной энергетике. В частности, изотоп 6Li служит промышленным источником для производства трития, а изотоп 7Li используется как теплоноситель в урановых реакторах. Благодаря способности лития легко соединяться с водородом, азотом, кислородом, серой, он применяется в металлургии для удаления следов этих элементов из металлов и сплавов. LiF и LiCl входят в состав флюсов, используемых при плавке металлов и сварке магния и алюминия. Используется литий и его соединения и в качестве топлива для ракет. Смазки, содержащие соединения лития, сохраняют свои свойства при температурах от —60 до +150°C. Гидроксид лития входит в состав электролита щелочных аккумуляторов (см. § 244), благодаря чему в 2—3 раза возрастает срок их службы. Применяется литий также в керамической, стекольной и других отраслях химической промышленности. Вообще, по значимости в современной технике этот металл является одним из важнейших редких элементов.
Цезий и рубидий применяются для изготовления фотоэлементов. В этих приборах, преобразующих лучистую энергию в энергию электрического тока и основанных на явлении фотоэлектрического эффекта (см. § 23), используется способность атомов цезия и рубидия отщеплять валентные электроды при действии на металл лучистой энергии.
- 547 -
Однако наибольшее практическое значение имеют натрий, калий и их соединенная.
| <<< Назад Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
Вперед >>> 198. Натрий (Natrium). |
- Глава 3 7,65 Как образовались «металлы»
- Получение и использование синтетических полимеров
- § 26. Полезные ископаемые. Металлы
- 950. Какие концентрации тяжелых металлов вредны для морских организмов?
- Глава 7 Получение нуклеотидов из продуктов атмосферной фотохимии
- Получение нуклеотидов
- Глава 21 По ту сторону физики Получение знания, имеющего смысл, но неизмеримого экспериментально…
- Получение кристаллов с определенными свойствами
- Получение кристаллов с заданным химическим составом
- Получение кристаллов заданной формы
- Получение крупногабаритных кристаллов
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
