Книга: Общая химия
97. Окислительно-восстановительная двойственность.
| <<< Назад 96. Важнейшие окислители и восстановители. |
Вперед >>> 98. Химические источники электрической энергии. |
97. Окислительно-восстановительная двойственность.
Внутримолекулярное окисление-восстановление. Соединения высшей степени окисленности, присущей данному элементу, могут в окислительно-восстановительных реакциях выступать только в качестве окислителей, степень окисленности элемента может в этом случае только понижаться. Соединения низшей степени окисленности могут быть, наоборот, только восстановителями; здесь степень окисленности элемента может только повышаться. Если же элемент находится в промежуточной степени окисленности, то его атомы могут, в зависимости от условий, как принимать, так и отдавать электроны. В первом случае степень окисленности элемента будет понижаться, во втором — повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисленности, обладают окислительно-восстановительной двойственностью-способностью вступать в реакции как с окислителями, так и с восстановителями.
Так, азот образует соединения, в которых степень его окисленности изменяется от —3 (аммиак и соли аммония) до +5 (азотная кислота и ее соли). Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты— только в качестве окислителя. Азотистая же кислота HNO2 и ее соли, где степень окисленности азота равна +3, вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В первом случае HNO2 окисляется до азотной кислоты, во втором — восстанавливается обычно до оксида азота NO2
- 263 -
В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
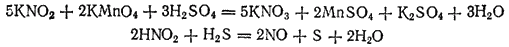
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
Вещества, содержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой (HClO) кислот:
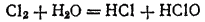
Здесь и окисление, и восстановление претерпевает хлор:
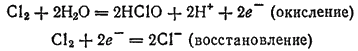
Самоокисление-самовосстановление называют также диспропорционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара
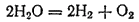
кислород окисляется (его степень окисленности возрастает от —2 до 0), а водород восстанавливается (его степень окисленности уменьшается от +1 до 0).
Другим примером может служить реакция разложения нитрита аммония, применяемая в лабораторной практике для получения чистого азота:
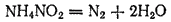
Здесь ион NH2+ окисляется, а ион NO2- восстанавливается до свободного азота.
| <<< Назад 96. Важнейшие окислители и восстановители. |
Вперед >>> 98. Химические источники электрической энергии. |
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
