Книга: Общая химия
129. Диоксид серы. Сернистая кислота.
| <<< Назад 128. Сероводород. Сульфиды. |
Вперед >>> 130. Триоксид серы. Серная кислота. |
129. Диоксид серы. Сернистая кислота.
Диоксид (двуокись) серы SO2 образуется при сжигании серы в воздухе или кислороде. Он получается также при прокаливании на воздухе («обжигании») сульфидов металлов, например железного колчедана:

По этой реакции диоксид серы получают обычно в промышленности (о других промышленных способах получения SO2 см, 9 § 131).
- 372 -
Диоксид серы — бесцветный газ («сернистый газ») с резким запахом горячей серы. Он довольно легко конденсируется в бесцветную жидкость, кипящую при -10.0°C. При испарении жидкого SO2 происходит сильное понижение температуры (до -50°C).
Диоксид серы хорошо растворяется в воде (около 40 объемов в 1 объеме воды при 20°C ); при этом частично происходит реакция с водой и образуется сернистая кислота:
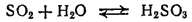
Таким образом, диоксид серы является ангидридом сернистой кислоты. При нагревании растворимость SO2 уменьшается и равновесие смещается влево; постепенно весь диоксид серы снова выделяется из раствора.
Молекула SO2 построена аналогично молекуле озона. Ядра составляющих ее атомов образуют равнобедренный треугольник:

Здесь атом серы, как и центральный атом кислорода в молекуле озона, находится в состоянии sp2-гибридизации и угол OSO близок к 120°. Ориентированная перпендикулярно к плоскости молекулы pz-орбиталь атома серы не участвует в гибридизации. За счет этой орбитали и аналогично ориентированных pz-орбиталей атомов кислорода образуется трехцентровая ?-связь; осуществляющая ее пара электронов принадлежит всем трем атомам молекулы.
Диоксид серы применяют для получения серной кислоты, а также (в значительно меньших количествах) для беления соломы, шерсти, шелка и как дезинфицирующее средство (для уничтожения плесневых грибков в подвалах, погребах, винных бочках, бродильных чанах).
Сернистая кислота H2SO3 — очень непрочное соединение. Она известна только в водных растворах. При попытках выделить сернистую кислоту она распадается на SO2 и воду. Например, при действии концентрированной серной кислоты на сульфит натрия вместо сернистой кислоты выделяется диоксид серы:

Раствор сернистой кислоты необходимо предохранять от доступа воздуха, иначе она, поглощая из воздуха кислород, медленно окисляется в серную кислоту:
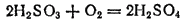
Сернистая кислота — хороший восстановитель. Например, свободные галогены восстанавливаются ею в галогеноводороды:

- 373 -
Однако при взаимодействии с сильными восстановителями сернистая кислота может играть роль окислителя. Так, реакция ее с сероводородом в основном протекает согласно уравнению:
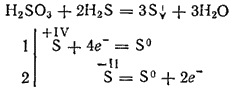
Будучи двухосновной (K1 ? 2·10-2, K2 = 6.3·10-8), сернистая кислота образует два ряда солей. Средние ее соли называются сульфитами, кислые — гидросульфитами.
Как и кислота, сульфиты и гидросульфиты являются восстановителями. При их окислении получаются соли серной кислоты.
Сульфиты наиболее активных металлов при прокаливании разлагаются с образованием сульфидов и сульфатов (реакция самоокисления - самовосстановления):
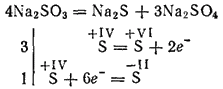
Сульфиты калия и натрия применяются для отбеливания некоторых материалов, в текстильной промышленности при крашении тканей, в фотографии. Раствор Ca(HSO3)2 (эта соль существует только в растворе) применяется для переработки древесины в так называемую сульфитную целлюлозу, из которой потом получают бумагу.
| <<< Назад 128. Сероводород. Сульфиды. |
Вперед >>> 130. Триоксид серы. Серная кислота. |
- КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- 134. Соединения серы с галогенами.
- 130. Триоксид серы. Серная кислота.
- Яблочная кислота полезна для здоровья
- 3.32. «ДРЕВЕСНАЯ КИСЛОТА». «КРИМИНАЛЬНОЕ» ПРОИСХОЖДЕНИЕ БЕНЗОЛЬНОГО КОЛЬЦА
- 3.28. КАК ПОЯВИЛОСЬ НАЗВАНИЕ «ЛИМОННАЯ КИСЛОТА»
- 3.30. ЕСТЬ ЛИ В ЯБЛОКАХ ЯБЛОЧНАЯ КИСЛОТА, А В ВИНЕ — ВИННАЯ?
- 5.2. ДИОКСИД УГЛЕРОДА В РОЛИ «НОСИЛЬЩИКА»
- 5.50. ЧТО ТАКОЕ КРАСНАЯ АЗОТНАЯ КИСЛОТА?
- 6.52. ОПАСНАЯ КИСЛОТА
- 5.13. ЧЕМ ДЫМИТ «ДЫМЯЩАЯ СЕРНАЯ КИСЛОТА»?
- 5.60. МОЖЕТ ЛИ КИСЛОТА ГОРЕТЬ?
- 9.45. МЕЛЛИТОВАЯ КИСЛОТА
