Книга: Общая химия
125. Озон.
| <<< Назад 124. Получение и свойства кислорода. |
Вперед >>> 126. Сера в природе. Получение серы. |
125. Озон.
При пропускании электрических искр через кислород или воздух появляется характерный запах, причиной которого является образование нового вещества — озона. Озон можно получить из совершенно чистого сухого кислорода; отсюда следует, что он состоит только из кислорода и представляет собой его аллотропическое видоизменение.
Молекулярная масса озона равна 48. Атомная же масса кислорода равна 16; следовательно, молекула озона состоит из трех атомов кислорода.
Для получения озона пользуются действием тихих электрических разрядов на кислород. Приборы, служащие для этой цели, называются озонаторами.
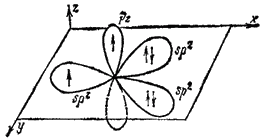
Рис. 110. Схема строения молекулы озона.

Рис. 111. Схема орбиталей центрального атома кислорода в молекуле озона.
При обычных условиях озон — газ. От кислорода его можно отделить сильным охлаждением; озон конденсируется в синюю жидкость, кипящую при -111,9°C.
Растворимость озона в воде значительно больше, чем кислорода: 100 объемов воды при 0°C растворяют 49 объемов озона.
Образование озона из кислорода можно выразить уравнением

из которого следует, что стандартная энтальпия образования озона положительна и равна 142,5 кДж/моль. Кроме того, как показывают коэффициенты уравнения, в ходе этой реакции из трех молекул газа получаются две молекулы, т. е. энтропия системы уменьшается. В итоге, стандартное изменение энергии Гиббса в рассматриваемой реакции также положительно (163 кДж/моль). Таким образом, реакция превращения кислорода в озон самопроизвольно протекать не может: для ее осуществления необходима затрата энергии. Обратная же реакция — распад озона — протекает самопроизвольно, так как в ходе этого процесса энергия Гиббса системы уменьшается. Иначе говоря, озон — неустойчивое вещество.
Молекула озона построена в форме равнобедренного треугольника. Ее структура схематически изображена на рис. 110. Близость угла при вершине треугольника к 120° указывает на то, что центральный атом кислорода находится здесь в состоянии sp2-гибридизации. В соответствии с этим, с позиций метода ВС образование молекулы O3 можно описать следующим образом.
Гибридная sp2-орбиталь центрального атома, содержащая один электрон (рис. 111, слева), перекрывается с px-орбиталью одного из крайних атомов кислорода, в результате чего образуется ?-связь. Не участвующая в гибридизации pz-орбиталь центрального атома, ориентированная перпендикулярно к плоскости молекулы и также содержащая неспаренный электрон, перекрывается с аналогично расположенной pz-орбиталью того же крайнего атома кислорода, что приводит к образованию ?-связи. Наконец, выступая в качестве донора электронной пары, занимающей одну из гибридных sp2-орбиталей (рис. 111, справа), центральный атом кислорода образует по донорно-акцепторному способу ?-связь с другим крайним атомом кислорода.
- 366 -
Образовавшейся структуре соответствует валентная схема А, на которой точками обозначены неподеленные пары электронов, а ?- и ?-связи помечены буквами.
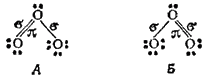
Согласно схеме А, связи центрального атома кислорода с двумя крайними атомами неравноценны — одна из них двойная, а другая простая. Однако одинаковая длина этих связей (рис. 110) указывает на их равноценность. Поэтому, наряду со схемой А, строение Молекулы озона с равным основанием можно описать схемой Б, С позиций метода наложения валентных схем (см. § 44) это означает, что в действительности структура молекулы озона является промежуточной между схемами А и Б и ее можно представить в форме:
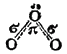
Здесь пунктирные линии указывают на делокализацию ?-электронной пары, т. е. на принадлежность ее всем трем атомам кислорода. Следовательно, ?-связь в молекуле озона — трехцентровая.
Рассмотрение строения молекулы озона с позиций метода МО также приводит к выводу об образовании здесь трехцентровои связывающей молекулярной ?-орбитали.
Озон — один из сильнейших окислителей. Он окисляет все металлы, кроме золота и платиновых металлов, а также большинство неметаллов. Он переводит низшие оксиды в высшие, а сульфиды металлов — в их сульфаты. В ходе большинства этих реакций молекула озона теряет один атом кислорода, переходя в молекулу O2.
Из раствора иодида калия озон выделяет иод:
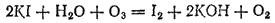
Если поместить в воздух, содержащий озон, бумажку, смоченную растворами KI и крахмала, то она тотчас же синеет. Этой реакцией пользуются для открытия озона.
Как сильный окислитель озон убивает бактерии и потому применяется для обеззараживания воды и для дезинфекции воздуха.
Озон ядовит. Предельно допустимым является его содержание в воздухе, равное 10-5%. При этой концентрации хорошо ощущается его запах. В приземном слое атмосферы содержание озона обычно лежит в пределах 10-7-10-6% он образуется в атмосфере при электрических разрядах.
- 367 -
| <<< Назад 124. Получение и свойства кислорода. |
Вперед >>> 126. Сера в природе. Получение серы. |
- КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- 3.3. Всем известный ацетилен
- Что такое вкус
- § 35 Трение и сопротивление среды
- Волк. Вопросы онтогенеза поведения, проблемы и метод реинтродукции
- Корабли Северо-Западной Европы
- 203. Основные положения координационной теории.
- Эпилог Пан или морлок: биологическое будущее человека
- Значения «начала бесконечности», встречающиеся в этой главе
- Путешествие хирурга по телу человека
- Библиография
- 8.2. Можно ли путешествовать во времени?
- Шпанка ясеневая, или нарывник (Lytta vesicatoria L.)
