Книга: Общая химия
135. Селен (Selenium). Теллур (Tellurium).
| <<< Назад 134. Соединения серы с галогенами. |
Вперед >>> Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ |
135. Селен (Selenium). Теллур (Tellurium).
Селен мало распространен в природе. В земной коре содержание селена составляет 0,00006% (масс.). Его соединения встречаются в виде примесей к природным соединениям серы с металлами (PbS, FeS2 и др.). Поэтому селен получают из отходов, образующихся при производстве серной кислоты, при электролитическом рафинировании меди и при некоторых других процессах.
Теллур принадлежит к числу редких элементов: содержание его в земной коре составляет всего 0,000001% (масс.).
В свободном состоянии селен, подобно сере, образует несколько аллотропических видоизменений, из которых наиболее известны аморфный селен, представляющий собой красно-бурый порошок, и серый селен, образующий хрупкие кристаллы с металлическим блеском.
Теллур тоже известен в виде аморфной модификации и в виде кристаллов светло-серого цвета, обладающих металлическим блеском.
Селен — типичный полупроводник (см. § 190). Важным свойством его как полупроводника является резкое увеличение электрической проводимости при освещении. На границе селена с металлическим проводником образуется запорный слой — участок цепи, способный пропускать электрический ток только в одном направлении. В связи с этими свойствами селен применяется в полупроводниковой технике для изготовления выпрямителей и фотоэлементов с запорным слоем. Теллур — тоже полупроводник, но его применение более ограничено. Селениды и теллуриды некоторых металлов также обладают полупроводниковыми свойствами и применяются в электронике. В небольших количествах теллур служит легирующей добавкой к свинцу, улучшая его механические свойства.
Селеноводород H2Se и теллуроводород H2Te представляют собой бесцветные газы с отвратительным запахом. Водные растворы их являются кислотами, константы диссоциации которых несколько больше, чем константа диссоциации сероводорода.
В химическом отношении селеноводород и теллуроводород чрезвычайно похожи на сероводород. Как и сероводород, они в сильной степени обладают восстановительными свойствами. При нагревании оба они разлагаются. При этом H2Te менее стоек, чем H2Se: подобно тому, как это происходит в ряду галогеноводородов, прочность молекул уменьшается при переходе H2O ?H2S?H2Se?H2Te. Соли селеноводорода и теллуроводорода — селениды и теллуриды — сходны с сульфидами в отношении растворимости в воде и кислотах. Действуя на селениды и теллуриды сильными кислотами, можно получить селеноводород и теллуроводород.
При сжигании селена и теллура на воздухе или в кислороде получаются диоксиды SeO2 и TeO2, находящиеся при обычных условиях в твердом состоянии и являющиеся ангидридами селенистой H2SeO3 и теллуристой H2TeO3 кислот.
- 383 -
В отличие от диоксида серы, SeO2 и TeO2 проявляют преимущественно окислительные свойства, легко восстанавливаясь до свободных селена и теллура, например:
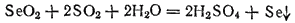
Действием сильных окислителей диоксиды селена и теллура могут быть переведены соответственно в селеновую H2SeO4 и теллуровую H2TeO4 кислоты.
Селеновая кислота H2SeO4 принадлежит к сильным кислотам. Подобно серной кислоте, она малолетуча, энергично соединяется с водой, обугливает органические вещества и обладает сильными окислительными свойствами. Соли ее — селенаты — очень похожи на сульфаты. Бариевая и свинцовая соли этой кислоты, как и соответствующие соли серной кислоты, нерастворимы.
Теллуровая кислота H2TeO4, в отличие от селеновой и серной, очень слабая кислота. Из раствора она выделяется в виде кристаллов ортотеллуровой кислоты состава H6TeO6. Это шестиосновная кислота; она образует ряд солей, например ортотеллурат серебра Ag6TeO6. При нагревании ортотеллуровая кислота отщепляет две молекулы воды и переходит в двухосновную кислоту H2TeO4.
Все соединения селена и теллура ядовиты.
| <<< Назад 134. Соединения серы с галогенами. |
Вперед >>> Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ |
- КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
