Книга: Общая химия
124. Получение и свойства кислорода.
| <<< Назад КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух. |
Вперед >>> 125. Озон. |
124. Получение и свойства кислорода.
Кислород был впервые получен в чистом виде К. В. Шееле в 1772 г., а затем в 1774 г. Д. Пристли (Англия), который выделил его из оксида ртути(II). Однако Пристли не знал, что полученный им газ входит в состав воздуха. Только спустя несколько лет Лавуазье, подробно изучивший свойства этого газа, установил, что он является составной частью воздуха.
В настоящее время в промышленности кислород получают из воздуха (см. § 123). В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода (см. стр. 337) или термическим разложением некоторых кислородсодержащих веществ, например перманганата калия:
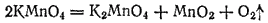
Кислород — бесцветный газ, не имеющий запаха. Он немного тяжелее воздуха: масса 1 л кислорода при нормальных условиях равна 1,43 г, а 1 л воздуха 1,293 г. Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0°C растворяют 4,9, а при 20°C - 3,1 объема кислорода.
Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500°C она становится заметной.
Как уже упоминалось (см. стр. 136), магнитные свойства кислорода указывают на наличие в молекуле O2 двух неспаренных электронов. Эти электроны размещаются на разрыхляющих молекулярных ?-орбиталях (рис. 52 на стр. 142). Парамагнитность кислорода проявляется, в частности, в том, что жидкий кислород притягивается магнитом.
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов ой взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры.
- 364 -
Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре. Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света. Такой процесс называется горением.
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горення в кислороде значительно выше, чем в воздухе.
Кислород играет исключительно важную роль в природе. При участии кислорода совершается один из важнейших жизненных процессов — дыхание. Важное значение имеет и другой процесс, в котором участвует кислород, — тление и гниение погибших животных и растений; при этом сложные органические вещества превращаются в более простые (в конечном результате в CO2, воду и азот), а последние вновь вступают в общий круговорот веществ в природе.
Применение кислорода весьма многообразно. Его применяют для интенсификации химических процессов во многих производствах (например, в производстве серной и азотной кислот, в доменном процессе). Кислородом пользуются для получения высоких температур, для чего различные горючие газы (водород, ацетилен) сжигают в специальных горелках. Кислород используют в медицине при затрудненном дыхании.
Смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами называются оксиликвитами. Они обладают очень сильными взрывчатыми свойствами и применяются при подрывных работах.
| <<< Назад КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух. |
Вперед >>> 125. Озон. |
- КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- Водород в природе. Получение водорода.
- 116. Свойства и применение водорода.
- Получение и использование синтетических полимеров
- 957. Почему так важно присутствие в воде растворенного кислорода?
- 7.5. Круговорот кислорода
- 316. Как океанологи прослеживают водные массы и границы течений по содержанию кислорода?
- 455. Какое количество кислорода может быть растворено в воде?
- 666. В чем заключается значение кислорода?
- 458. Существуют ли в океане водные массы, не содержащие кислорода?
- 457. Как изменялось содержание кислорода в течение геологических эпох?
- 12. Задыхаясь без кислорода
- Образование и исчезновение пригодного для дыхания кислорода
