Книга: Общая химия
КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух.
| <<< Назад Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ |
Вперед >>> 124. Получение и свойства кислорода. |
КИСЛОРОД (OXYGENIUM)
123. Кислород в природе. Воздух.
Кислород — самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе, в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Массовая доля кислорода в земной коре составляет около 47%.
Природный кислород состоит из трех стабильных изотопов: 16O(99.76%) и 18O(0.2%).
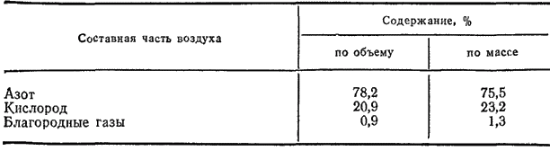
Атмосферный воздух представляет собой смесь многих газов. Кроме кислорода и азота, образующих основную массу воздуха, в состав его входят в небольшом количестве благородные газы, диоксид углерода и водяные пары. Помимо перечисленных газов, в воздухе содержится еще большее или меньшее количество пыли и некоторые случайные примеси. Кислород, азот и благородные газы считаются постоянными составными частями воздуха, так как их содержание в воздухе практически повсюду одинаково. Содержание же диоксида углерода, водяных паров и пыли может изменяться в зависимости от условий.
Диоксид углерода образуется в природе при горении дерева и угля, дыхании животных, гниении. Особенно много CO2 как продукта сжигания огромных количеств топлива поступает в атмосферу в больших промышленных центрах.
В некоторых местах земного шара CO2 выделяется в воздух вследствие вулканической деятельности, а также из подземных источников. Несмотря на непрерывное поступление диоксида углерода в атмосферу, содержание его в воздухе довольно постоянно и составляет в среднем около 0..3%(об). Это объясняется поглощением диоксида углерода растениями, а также его растворением в воде.
Водяные пары могут находиться в воздухе в различных количествах. Содержание их колеблется от долей процента до нескольких процентов и зависит от местных условий и от температуры.
Пыль, находящаяся в воздухе, состоит главным образом из мельчайших частиц минеральных веществ, образующих земную кору, частичек угля, пыльцы растений, а также различных бактерий. Количество пыли в воздухе очень изменчиво: зимой ее меньше, летом больше.
- 362 -
После дождя воздух становится чище, так как капли дождя увлекают с собой пыль.
Наконец, к случайным примесям воздуха относятся такие вещества, как сероводород и аммиак, выделяющиеся при гниении органических остатков; диоксид серы SO2, получающийся при обжиге сернистых руд или при горении угля, содержащего серу; оксиды азота, образующиеся при электрических разрядах в атмосфере, и т. п. Эти примеси обычно встречаются в ничтожных количествах и постоянно удаляются из воздуха, растворяясь в дождевой воде.
Если учитывать только постоянные составные части воздуха, то его состав можно выразить данными, приведенными в табл. 26.
Таблица 26. Состав воздуха
Масса 1 л воздуха при 20°C и нормальном атмосферном давлении равна 1,293 г. При температуре -140°C и давлении около 4 МПа воздух конденсируется в бесцветную прозрачную жидкость.
Несмотря на низкую при обычном давлении температуру кипения (около -190°C), жидкий воздух можно довольно долго сохранять в сосудах Дьюара — стеклянных сосудах с двойными стенками, из пространства между которыми воздух откачан (рис. 109).
В жидком воздухе легко переходят в твердое состояние этиловый спирт, диэтиловый эфир и многие газы. Если, например, пропускать через жидкий воздух диоксид углерода, то он превращается в белые хлопья, похожие по внешнему виду на снег. Ртуть, погруженная в жидкий воздух, становится твердой и ковкой.
Многие вещества, охлажденные жидким воздухом, резко изменяют свои свойства. Так, цинк и олово становятся настолько хрупкими, что легко превращаются в порошок, свинцовый колокольчик издает чистый звенящий звук, а замороженный резиновый мячик разбивается вдребезги, если уронить его на пол.
Поскольку температура кипения кислорода (-183°C) лежит выше, чем температура кипения азота (-195,8°C) , то кислород легче превращается в жидкость, чем азот.
Рис. 109. Сосуды Дьюара (в разрезе).
- 363 -
Поэтому жидкий воздух богаче кислородом, чем атмосферный. При хранении жидкий воздух еще больше обогащается кислородом вследствие преимущественного испарения азота.
Жидкий воздух производят в больших количествах. Он используется главным образом для получения из него кислорода, азота и благородных газов; разделение производят путем ректификации — дробной перегонки.
| <<< Назад Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ |
Вперед >>> 124. Получение и свойства кислорода. |
- КИСЛОРОД (OXYGENIUM) 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- 124. Получение и свойства кислорода.
- 126. Сера в природе. Получение серы.
- 2. КИСЛОРОД
- 957. Почему так важно присутствие в воде растворенного кислорода?
- 801. Почему водолазы не дышат чистым кислородом?
- 7.5. Круговорот кислорода
- 667. Каким образом кислород попадает в морскую воду?
- 316. Как океанологи прослеживают водные массы и границы течений по содержанию кислорода?
- 455. Какое количество кислорода может быть растворено в воде?
- 666. В чем заключается значение кислорода?
- 456. На что расходуется растворенный в воде кислород?
- 458. Существуют ли в океане водные массы, не содержащие кислорода?
