Книга: Общая химия
101. Электролиз.
| <<< Назад 100. Ряд напряжений металлов. |
Вперед >>> 102. Законы электролиза. |
101. Электролиз.
Электролизом называется совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCl2 катионы магния под действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются
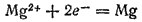
Анионы хлора перемещаются к положительному электроду и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия — окисление ионов хлора
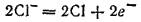
а вторичным — связывание образующихся атомов хлора в молекулы:
2Cl=Cl2
Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgCl2:

Эта реакция не может протекать самопроизвольно; энергия, необходимая для ее осуществления, поступает от внешнего источника тока.
Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод - положительно, т. е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию.
При рассмотрении электролиза водных растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются еще ионы, являющиеся продуктами диссоциации воды — H+ и OH-. В электрическом поле ионы водорода перемещаются к катоду, а ионы OH- — к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода.
- 286 -
Аналогично у анода может происходить разряд как анионов электролита, так и гидроксид-ионов. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению.
Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего будет зависеть от относительных значений электродных потенциалов соответствующих электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже.
Рассматривая катодные процессы, протекающие при электролизе водных растворов, ограничимся важнейшим случаем — катодным восстановлением, приводящим к выделению элементов в свободном состоянии. Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода (см. стр. 273) и в случае нейтральных растворов (pH=7) имеет значение ?=-0.059·7=-0.41 В. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем —0,41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана. Наконец, если потенциал металла близок к значению —0,41 В (металлы средней части ряда — Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза* возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды:
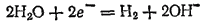
* К важнейшим условиям электролиза относятся плотность тока, температура, состав раствора. Плотностью тока называется отношение силы тока к рабочей площади электрода.
- 287 -
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют pH раствора, концентрация ионов металла и другие условия электролиза.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину.
На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фторо-водорода и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от pH раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид
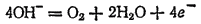
а в кислой или нейтральной:
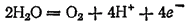
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO42-

равен 2,01 В, что значительно превышает стандартный потенциал окисления воды (1,229 В). Стандартный потенциал окисления иона F- имеет еще большее значение (2,866 В).
При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI,HBr, HCl и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе HCl и ее солей противоречит взаимному положению систем
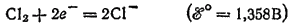
и
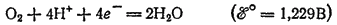
в ряду стандартных электродных потенциалов.
Эта аномалия связана со значительным перенапряжением (см. § 104) второго и этих двух электродных процессов — материал анода оказывает тормозящее действие на процесс выделения кислорода.
- 288 -
В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона (т. е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Рассмотрим несколько типичных случаев электролиза водных растворов.
Электролиз раствора CuCl2 с инертным анодом. Медь в ряду напряжений расположена после водорода: поэтому у катода будет происходить разряд ионов Cu2+ и выделение металлической меди. У анода будут разряжаться хлорид-ионы.
Схема электролиза раствора хлорида меди(II):
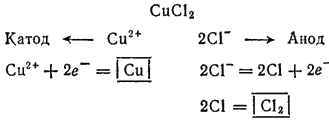
Электролиз раствора K2SO4 с инертным анодом. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионов OH-. У анода будет идти выделение кислорода и накопление ионов H+. В то же время в катодное пространство будут приходить ионы K+, а в анодное — SO42-. Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном — кислота.
Схема электролиза раствора сульфата калия:
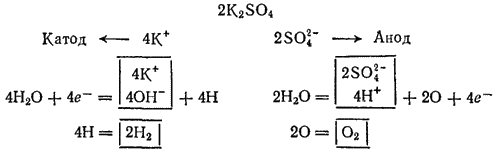
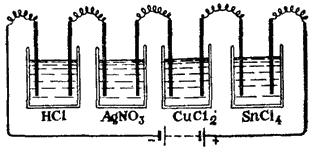
Рис. 86. Схема установки иллюстрирующей, закон Фарадея.
- 289 -
Электролиз раствора NiSO4 с никелевым анодом. Стандартный потенциал никеля (-0.250 В) несколько больше, чем —0,41 В; поэтому при электролизе нейтрального раствора NiSO4 на катоде в основном происходит разряд ионов Ni2+ и выделение металла. На аноде происходит противоположный процесс — окисление металла, так как потенциал никеля намного меньше потенциала окисления воды, а тем более — потенциала окисления иона SO42-. Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде.
Схема электролиза раствора сульфата никеля:
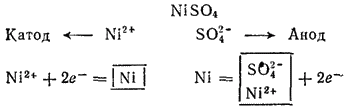
Этот процесс применяется для электрической очистки никеля (так называемое электролитическое рафинирование, см. § 103).
| <<< Назад 100. Ряд напряжений металлов. |
Вперед >>> 102. Законы электролиза. |
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Электролиз.
- 6.39. БЕЗ ЭЛЕКТРОЛИЗА
- 103. Электролиз в промышленности.
- 102. Законы электролиза.
- § 53 Соли и их применение
- Применение солей.
- Проверьте свои знания
- Устройство фотосинтеза современных растений и цианобактерий
- Почему некоторые люди такие волосатые?
- Переправа электрических путешественников
- Появляются новые термины
- Химическое действие тока
