Книга: Общая химия
99. Электродные потенциалы.
| <<< Назад 98. Химические источники электрической энергии. |
Вперед >>> 100. Ряд напряжений металлов. |
99. Электродные потенциалы.
Каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления. Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде; поэтому полуреакции называют также электродными процессами.
В § 98 было показано, что протекающей в гальваническом элементе окислительно-восстановительной реакции соответствует э.д.с. этого элемента Е, связанная с изменением энергии Гиббса ?G реакции уравнением:
?G = -zFE
В соответствии с разделением окислительно-восстановительной реакции на две полуреакции, электродвижущие силы также принято представлять в виде разности двух величии, каждая из которых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
Для медно-цинкового элемента реакция, протекающая при его работе
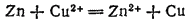
разбивается на полуреакции:

- 271 -
Соответственно э.д.с. этого элемента (Е) можно представить как разность электродных потенциалов ( ?), один из которых (?1) отвечает первой, а другой (?2) — второй из записанных полуреакций:
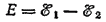
При этом изменение энергии Гиббса ?G1, которое отвечает термодинамически обратимому восстановлению одного моля ионов меди, равно
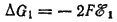
а изменение энергии Гиббса ?G2 отвечающее термодинамически обратимому окислению одного моля атомов цинка, равно
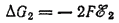
В общем случае любому электродному процессу
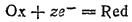
соответствует электродный потенциал ? и изменение энергии Гиббса ?G, равное:
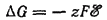
Здесь Red и Ox — сокращения латинских слов, обозначающие восстановленную и окисленную формы веществ, участвующих в электродном процессе.
В дальнейшем, говоря об электродных процессах, мы будем записывать их уравнения в сторону восстановления (за исключением, конечно, тех случаев, когда речь будет идти именно об окислении).
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех факторов: 1) от природы веществ — участников электродного процесса, 2) от соотношения между концентрациями этих веществ и 3) от температуры системы. Эта зависимость выражается уравнением:
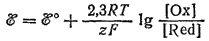
Здесь ?° — стандартный электродный потенциал данного процесса — константа, физический смысл которой рассмотрен ниже; R — газовая постоянная; Т — абсолютная температура; z — число электронов, принимающих участие в процессе; F — постоянная Фарадея; [Ox] и [Red] произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и в восстановленной (Red) формах.
- 272 -
Физический смысл величины ?° становится ясным при рассмотрении случая, когда концентрации (активности) всех веществ, участвующих в данном электродном процессе, равны единице. При этом условии второе слагаемое правой части уравнения обращается в нуль (lg1 = 0) и уравнение принимает вид:
? = ?°
Концентрации (активности), равные единице, называются стандартными концентрациями (активностями). Поэтому и потенциал, отвечающий этому случаю, называется стандартным потенциалом. Итак, стандартный электродный потенциал — это потенциал данного электродного процесса при концентрациях (точнее говоря, активностях) всех участвующих в нем веществ, равных единице.
Таким образом, в уравнении электродного потенциала первое слагаемое (?°) учитывает влияние на его величину природы веществ, а второе
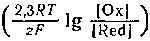
Для обычной при электрохимических измерениях стандартной температуры (25°C =298 K), при подстановке значений постоянных величин (R=8,31 Дж/(моль·К), F=96 500 Кл/моль) уравнение принимает вид:

Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс
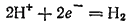
Изменение энергии Гиббса, связанное с протеканием этой полуреакции при стандартных условиях, принимается равным нулю. В соответствии с этим и стандартный потенциал данного электродного процесса принят равным нулю. Все электродные потенциалы, приводимые в настоящей книге, а также в большинстве других современных изданий, выражены по этой, так называемой водородной шкале.
Приведенный выше электродный процесс осуществляется на водородном электроде. Последний представляет собой платиновую пластинку, электролитически покрытую губчатой платиной и погруженную в раствор кислоты, через который пpoпускается водород (рис. 84). Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (пластина катализирует этот распад). На поверхности соприкосновения платины с раствором кислоты может протекать, окисление атомов или восстановление ионов водорода.
- 273 -
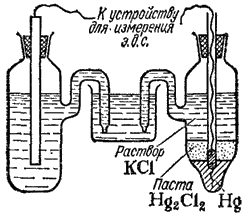
Рис. 84. водородный электрод.
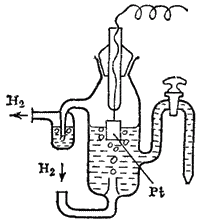
Рис. 85. Цепь для измерения электродного потенциала: слева — электрод, потенциал которого нужно измерить;справа — каломельный электрод; в середине — соединительный сосуд.
Платина при этом практически не принимает участия в электродных реакциях и играет как бы роль губки, пропитанной атомарным водородом.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Установим, какой вид принимает общее уравнение электродного потенциала для водородного электрода. В соответствии с уравнением электродного процесса (см. стр. 271) z=2,[Ox]=[H+]2, [Red]=[H2]. Концентрация растворенного в платине водорода пропорциональна его парциальному давлению pH2:
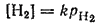
где k — постоянная при данной температуре величина. Включая ее в значение ?°, получим:
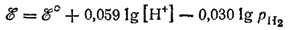
Обычно парциальное давление водорода pH2 поддерживается равным нормальному атмосферному давлению, которое условно принимается за единицу. В этом случае последний член полученного уравнения обращается в нуль (lg 1 = 0). Тогда
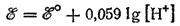
Поскольку стандартный потенциал рассматриваемого процесса, принят равным нулю, то
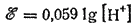
или, учитывая, что lg[H+]=-pH, окончательно получим:
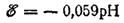
- 274 -
Для определения потенциала того или иного электродного процесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его э. д. с. Поскольку потенциал стандартного водородного электрода равен нулю, то измеренная э. д. с будет представлять собою потенциал данного электродного процесса.
Практически при измерениях потенциалов в качестве электрода сравнения пользуются не стандартным водородным, а другими электродами, более удобными в обращении, потенциалы которых по отношению к стандартному водородному электроду известны. При этом необходимо рассчитать э. д. с. элемента согласно уравнению:
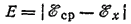
Здесь Е — э.д.с. элемента; ?ср — известный потенциал электрода сравнения; ?x - потенциал испытуемого электрода.
Решая уравнение относительно ?x получаем:

В качестве электродов сравнения чаще всего применяют хлор-серебряный и каломельный электроды. Хлорсеребряный электрод — это серебряная проволочка, покрытая слоем AgCl и погруженная в раствор соляной кислоты или ее соли. При замкнутой цепи на нем протекает реакция:
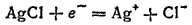
Каломельный электрод представляет собой ртуть, покрытую взвесью каломели Hg2Cl2 в растворе KCl. Потенциалы этих электродов воспроизводятся с высокой точностью. На рис. 85 изображена цепь с каломельным электродом.
Для того чтобы найти значение электродного потенциала, необходимо измерить не напряжение работающего элемента, а именно его э. д. с. При измерениях э. д. с. сопротивление внешней цепи (т. е. измерительного устройства) очень велико. Реакция в элементе при этом практически не протекает. Таким образом, электродные потенциалы отвечают обратимому протеканию процессов или, что то же самое, состоянию электрохимического равновесия на электродах. Поэтому электродные потенциалы часто называют равновесными электродными потенциалами или просто равновесными потенциалами.
Рассмотрим теперь, какой вид принимает общее уравнение электродного потенциала в важнейших случаях.
1. Электродный процесс выражается уравнением
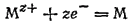
где М обозначает атомы какого-либо металла, Mz+ - его z-зарядные ионы.
- 275 -
К этому случаю относятся оба электрода медно-цинкового элемента и вообще любой металлический электрод в растворе соли этого же металла. Здесь окисленной формой металла являются его ионы, а восстановленной — атомы. Следовательно, [Ox]=[Mz+], так как концентрация атомов в металле при постоянной температуре — величина постоянная. Включая значение этой постоянной в величину ?° получим:
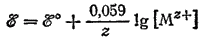
Например, для процесса Ag+ + e-=Ag
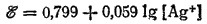
а для процесса Zn2+ + 2e-=Zn
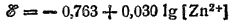
2, Электродный процесс выражается уравнением:
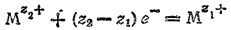
В этом случае и окисленная (Mz2+) и восстановленная (Mz1+) формы металла находятся в растворе и их концентрации —величины переменные. Поэтому
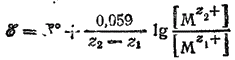
Например, для процесса Fe3+ + e- = Fe2+:
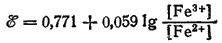
В этом и в рассматриваемых ниже случаях электрод, на котором протекает электродный процесс, изготовляется из инертного материала. Чаще всего в качестве такого материала применяют платину.
Мы рассмотрели примеры, когда в электродных процессах принимали участие только ионы, состоящие из одного элемента. Однако часто окисляющееся или восстанавливающееся вещество состоит не из одного, а из двух или большего числа элементов. Чаще всего в составе окислителя содержится кислород; при этом в электродном процессе обычно принимают участие также вода и продукты ее диссоциации — ионы водорода (в кислой среде) или гидроксид-ионы (в щелочной среде). Рассмотрим, как будут выглядеть в таких случаях уравнения потенциалов электродных процессов.
3. Электродный процесс выражается уравнением:
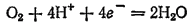
- 276 -
Эта полуреакция (при протекании ее в сторону восстановления) играет очень большую роль при коррозии металлов (см. § 196). Кислород — самый распространенный окислитель, вызывающий коррозию металлов в водных средах.
В рассматриваемом электродном процессе в результате восстановления кислорода, протекающего с участием ионов водорода, образуется вода. Следовательно, [Red]=[H2O]2 , а [Ox]=[O2][H+]4. Концентрацию воды в разбавленных растворах можно считать постоянной. Концентрация кислорода в растворе пропорциональна его парциальному давлению над раствором ([O2]=dpO2). Выполнив необходимые преобразования и обозначив сумму постоянных величин через ?°, получим:
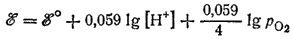
Для рассматриваемого процесса ?° =1.228 B; следовательно
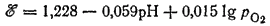
При парциальном давлении кислорода, равном нормальному атмосферному давлению (которое условно принимается равным единице), lg pO2 =0 и последнее уравнение принимает вид
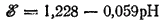
4. Для электродных процессов, записываемых более сложными уравнениями, в выражениях для потенциалов содержится большее число переменных концентраций. Рассмотрим, например, электродный процесс:
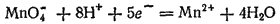
Эта полуреакция протекает (в сторону восстановления) при взаимодействии перманганата калия с большинством восстановителей в кислой среде.
Концентрации всех веществ, участвующих в рассматриваемом электродном процессе, кроме воды, — величины переменные. Для этого процесса ?° =1.507 B. Уравнение электродного потенциала имеет вид:
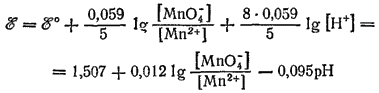
Примеры 3 и 4 показывают, что в случае электрохимических процессов, протекающих с участием воды, концентрация ионов водорода входит в числитель логарифмического члена уравнения потенциала. Поэтому электродные потенциалы таких процессов зависят от pH раствора и имеют тем большую величину, чем кислее раствор.
- 277 -
Таблица 18. Электродные потенциалы в водных растворах при 25°C и при парциальном давлении газов, равном нормальному атмосферному давлению

- 278 -
Продолжение табл. 18

Как уже сказано, зависимость электродного потенциала от природы веществ — участников электродного процесса учитывается величиной ?°. В связи с этим все электродные процессы принято располагать в ряд по величине их стандартных потенциалов. В табл. 18 уравнения важнейших электродных процессов и соответствующие электродные потенциалы приведены в порядке возрастания величин ?°.
Положение той или иной электрохимической системы в этом ряду характеризует ее окислительно-восстановительную способность. Под электрохимической системой здесь подразумевается совокупность всех веществ — участников данного электродного процесса.
Окислительно-восстановительная способность представляет собою понятие, характеризующее именно электрохимическую систему, но часто говорят и об окислительно-восстановительной способности того или иного вещества (или иона). При этом следует, однако, иметь в виду, что многие вещества могут окисляться или восстанавливаться до различных продуктов. Например, перманганат калия (ион MnO4-) может в зависимости от условий, прежде всего от pH раствора, восстанавливаться либо до иона Mn2+, либо до MnO2, либо до иона MnO4-
Соответствующие электродные процессы выражаются уравнениями:
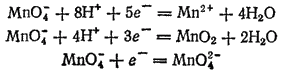
- 279 -
Поскольку стандартные потенциалы этих трех электродных процессов различны (см. табл. 18), то различно и положение этих трех систем в ряду Таким образом, один и тот же окислитель (MnO4-) может занимать в ряду стандартных потенциалов несколько мест.
Элементы, проявляющие в своих соединениях только одну степень окисленности, имеют простые окислительно-восстановительные характеристики и занимают в ряду стандартных потенциалов мало мест. К их числу относятся в основном металлы главных подгрупп I—III групп периодической системы. Много же мест в ряду занимают те элементы, которые образуют соединения различных степеней окисленности — неметаллы и многие металлы побочных подгрупп периодической системы.
Ряд стандартных электродных потенциалов позволяет решать вопрос о направлении самопроизвольного протекания окислительно-восстановительных реакций. Как и в общем случае любой химической реакции, определяющим фактором служит здесь знак изменения энергии Гиббса реакции. Если из двух электрохимических систем составить гальванический элемент, то при его работе электроны будут самопроизвольно переходить от отрицательного полюса элемента к положительному, т. е. от электрохимической системы с более низким значением электродного потенциала к системе с более высоким его значением. Но это означает, что первая из этих систем будет выступать в качестве восстановителя, а вторая— в качестве окислителя. Следовательно, в гальваническом элементе окислительно-восстановительная реакция может самопроизвольно протекать в таком направлении, при котором электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, т. е. восстанавливается. При непосредственном взаимодействии веществ возможное направление реакции будет, конечно, таким же, как и при ее осуществлении в гальваническом элементе.
Если окислитель и восстановитель расположены далеко друг от друга в ряду ?°, то направление реакции практически полностью определяется их взаимным положением в этом ряду. Например, цинк (?°=-0.763 B) будет вытеснять медь (?°=+0.337 B) из водного раствора ее соли при любой практически осуществимой концентрации этого раствора. Если же величины ?° для окислителя и восстановителя близки друг к другу, то при решении вопроса о направлении самопроизвольного протекания реакции необходимо учитывать влияние на электродные потенциалы также и концентраций соответствующих веществ. Например, реакция
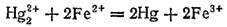
может самопроизвольно идти как слева направо, так и справа налево. Направление ее протекания определяется концентрациями ионов железа и ртути. В этой реакции участвуют две электрохимические системы:
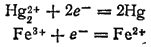
- 280 -
Соответствующим электродным процессам отвечают потенциалы:
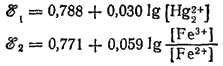
Подсчитаем величины ?°1 и ?°2 при [Hg22+] = [Fe2+] = 10-1 и [Fe3+] = 10-4 моль/1000 г. H2O:
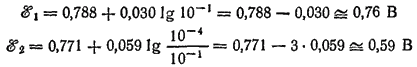
Таким образом, при взятом соотношении концентраций ?°1 > ?°2 и реакция протекает слева направо.
Теперь подсчитаем ?°1 и ?°2 при обратном соотношении концентраций. Пусть [Hg22+] = [Fe2+] = 10-4, а [Fe3+] = 10-4 моль/1000 г. H2O
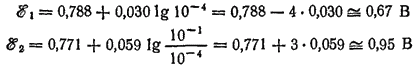
Следовательно, при этих концентрациях ?°1 > ?°2 и реакция протекает справа налево.
Если окислительно-восстановительная реакция протекает с участием воды и ионов водорода или гидроксид-ионов, то необходимо учитывать также величину pH среды.
В табл. 18 включено 39 полуреакций; комбинируя их друг с другом, можно решить вопрос о направлении самопроизвольного протекания 39·38/2=741 реакции.
Пример. Установить, направление возможного протекания реакции:
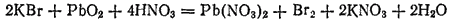
Запишем уравнение реакции в ионно-молекулярной форме:
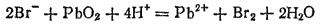
В табл. 18 находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции:
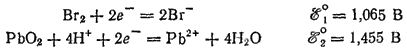
Окислителем всегда служит электрохимическая система с более высоким значением электродного потенциала. Поскольку здесь ?°2 значительно больше, чем ?°1, то практически при любых концентрациях взаимодействующих веществ бромид-ион будет служить восстановителем и окисляться диоксидом свинца: реакция будет самопроизвольно протекать слева направо.
Чем дальше находится та или иная система в ряду стандартных потенциалов, т. е. чем больше ее стандартный потенциал, тем более сильным окислителем является ее окисленная форма.
- 281 -
И, наоборот, чем раньше расположена система в ряду, т. е. чем меньше значение ?°, тем более сильный восстановитель ее восстановленная форма. Действительно, среди окисленных форм систем конца ряда мы находим такие сильные окислители, как F2, H2O2, MnO4-. Самые же сильные восстановители — восстановленные формы систем начала ряда: щелочные и щелочноземельные металлы.
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции — возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается — наступает состояние химического равновесия.
| <<< Назад 98. Химические источники электрической энергии. |
Вперед >>> 100. Ряд напряжений металлов. |
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- 2.5.1. Мембранные потенциалы
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 103. Электролиз в промышленности.
- 102. Законы электролиза.
- 100. Ряд напряжений металлов.
- 94. Окислительно-восстановительные реакции.
- 104. Электрохимическая поляризация.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
