Книга: Общая химия
95. Составление уравнений окислительно-восстановительных реакций.
| <<< Назад 94. Окислительно-восстановительные реакции. |
Вперед >>> 96. Важнейшие окислители и восстановители. |
95. Составление уравнений окислительно-восстановительных реакций.
В § 94 мы рассмотрели простейший пример окислительно-восстановительной реакции — образование соединения из двух простых веществ. Обычно уравнения окислительно-восстановительных реакций носят более сложный характер и расстановка коэффициентов в них часто представляет довольно трудную задачу; приведем несколько примеров.
- 258 -
Пример 1. Взаимодействие между иодоводородом и концентрированной серной кислотой. Эта реакция протекает согласно схеме:
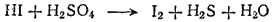
Если мы подсчитаем степень окисленности каждого элемента в исходных веществах и в продуктах реакции, то увидим, что она изменяется у иода и у серы. У иода в HI она равна —1, а в свободном иоде 0. Степень же окисленности серы изменяется от +6 (в H2SO4) до —2 (в H2S). Таким образом, степень окисленности иода повышается, а серы — понижается. Следовательно, иод окисляется, а сера восстанавливается.
Уравнение процесса окисления иода имеет простой вид:

Уравнение восстановления серы более сложно, так как и исходное вещество (H2SO4 или SO42-), и продукт реакции (H2S) кроме серы содержат другие элементы. При составлении этого уравнения будем исходить из того, что реакция протекает в кислой водной среде, а ион SO42- превращается в молекулу H2S:
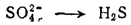
Четыре атома кислорода, высвобождающиеся при этом процессе, должны связаться в четыре молекулы воды. Для этого понадобятся восемь ионов водорода. Кроме того, два иона водорода необходимы для образования молекулы H2S. Следовательно, с ионом SO42- должны взаимодействовать десять ионов водорода:
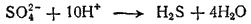
Суммарный заряд ионов, находящихся в левой части этой схемы, равен восьми элементарным положительным зарядам, а в правой ее части имеются лишь незаряженные частицы. Поскольку суммарный заряд в ходе процесса не изменяется, то, следовательно, в процессе восстановления принимают участие также восемь электронов:

В рассматриваемом примере отношение числа электронов, принимаемых в процессе восстановления, к числу электронов, высвобождающихся при окислении, равно 4:1. Для получения суммарного уравнения реакции надо, складывая уравнения процессов восстановления и окисления, учесть это соотношение — умножить уравнение восстановления на 4. При этом в записи обычно справа от вертикальной черты проставляются необходимые множители:

- 259 -
Полученное уравнение реакции может быть представлено и в молекулярной форме:
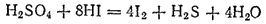
Пример 2. Взаимодействие алюминия с нитратом калия в щелочной среде. Схема реакции:
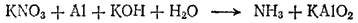
Здесь степень окисленности изменяется у азота и алюминия. Металлический алюминий (степень окисленности равна 0) превращается в ион AlO2-, в котором степень окисленности алюминия равна +3. Для составления уравнения окисления будем исходить из схемы:
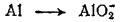
В щелочной среде источником кислорода, необходимого для протекания этого процесса, служат ионы OH-. Для связывания одного атома алюминия в AlO2- необходимо четыре гидроксид-иона:
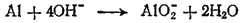
В левой части схемы имеются четыре отрицательных заряда, а в правой — один. Следовательно, в ходе процесса отдаются три электрона:
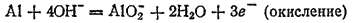
Для получения уравнения восстановления будем исходить из схемы:

Здесь в ходе процесса атомы азота лишаются атомов кислорода и связываются с атомами водорода. В щелочной среде это возможно при участии молекул воды. Три молекулы воды понадобятся для связывания трех атомов кислорода и еще три молекулы, воды — для образования молекулы NH3:

Суммарный заряд правой части схемы равен девяти отрицательным зарядам, а левой — одному. Следовательно, в процессе принимают участие восемь электронов:
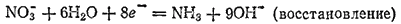
Отношение числа электронов, высвобождающихся в процессе окисления, к числу электронов, принимаемых при восстановлении, в данном примере равно 3:8. Следовательно, для получения суммарного уравнения реакции необходимо сложить уравнения процессов окисления и восстановления, умножив первое из них на 8, а второе на 3.
- 260 -
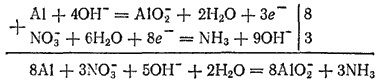
или в молекулярной форме:

Пример 3. Каталитическое окисление аммиака. Этой реакцией пользуются в производстве азотной кислоты (см. § 143). Ее осуществляют при температуре около 750°C. Схема реакции:
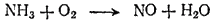
При 750°C конденсация водяного пара невозможна. Поэтому мы не будем записывать уравнения процессов окисления и восставновления так, как это делалось для реакций, протекающих в водной среде — с участием молекул воды, ионов водорода или гидроксид-ионов. Подсчитаем лишь число электронов, принимающих участие в окислении и восстановлении. При этом учтем, что повышение степени окисленности элемента равно числу отданных, а понижение — числу принятых электронов.
Согласно схеме реакции, степень окисленности изменяется у азота и у кислорода. У азота она возрастает от —3 до +2, а у кислорода уменьшается от 0 до —2. Запишем эти изменения в виде схем, отмечая степени окисленности элементов над их символами. Во избежание путаницы с зарядом иона, будем при этом пользоваться римскими цифрами:
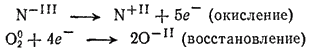
Отношение числа электронов, принимаемых при восстановлении, к числу электронов, высвобождающихся при окислении, равно 4:5. Следовательно, пять молекул кислорода могут окислить четыре молекулы аммиака:

Составление уравнений реакций в трех рассмотренных примерах проведено в определенном порядке. Его можно придерживаться и в других случаях при составлении уравнений окислительно-восстановительных реакций. Последовательность действий при этом следующая:
1. Составить схему реакции с указанием исходных и образующихся веществ.
2. Определить степень окисленности элементов в веществах правой и левой части схемы; отметить элементы, степень окисленности которых изменяется.
- 261 -
3. Составить уравнения процессов восстановления и окисления; найти отношение числа электронов, принимаемых при восстановлении и отдаваемых при окислении.
4. Сложить уравнения окисления и восстановления с учетом найденного отношения числа электронов (п. 3).
| <<< Назад 94. Окислительно-восстановительные реакции. |
Вперед >>> 96. Важнейшие окислители и восстановители. |
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Практическое значение смещенных реакций
- 2.6. Биосинтез белка и нуклеиновых кислот. Матричный характер реакций биосинтеза. Генетическая информация в клетке. Гены...
- 7.2. Экосистема (биогеоценоз), ее компоненты: продуценты, консументы, редуценты, их роль. Видовая и пространственная стр...
- Типы химических реакций.
- Скорость и энергия химических реакций
- § 51 Скорость и энергия химических реакций
- Схемы и уравнения реакций.
