Книга: Общая химия
96. Важнейшие окислители и восстановители.
| <<< Назад 95. Составление уравнений окислительно-восстановительных реакций. |
Вперед >>> 97. Окислительно-восстановительная двойственность. |
96. Важнейшие окислители и восстановители.
Какие вещества могут проявлять свойства окислителей, а какие — восстановителей? Как уже говорилось, окислитель содержит в своем составе элемент, понижающий степень своей окисленности, а восстановитель содержит элемент, степень окисленности которого повышается в ходе реакции. Следовательно, окислителями могут быть прежде всего соединения высших, а восстановителями — низших степеней окисленности, присущих данному элементу.
Металлы проявляют в своих соединениях только положительную окисленность, и низшая их степень окисленности равна нулю. Иначе говоря, низшей степенью окисленности они обладают только в свободном состоянии. Действительно, все свободные металлы способны, хотя и в различной степени, проявлять только восстановительные свойства. На практике в качестве восстановителей применяют алюминий, магний, натрий, калий, цинк и некоторые другие металлы. Если металлу присущи несколько степеней окисленности, то те его соединения, в которых он проявляет низшую из них, также обычно являются восстановителями, например, соединения железа (II), олова (II), хрома (II), меди (I).
Окислителями могут быть те соединения металлов, в которых степень окисленности металла велика — равна номеру группы, в которой находится металл, или близка к нему. На практике применяют, в частности: аммиачный раствор оксида серебра, аммиачный раствор сульфата меди (II), хлорид ртути(II), диоксид свинца PbO2, хлорид железа(III), хромат и дихромат калия (K2CrO4 и K2Cr2O7) , перманганат калия KMnO4, диоксид марганца MnO2.
Неметаллы проявляют как положительную, так и отрицательную окисленность. Естественно, что соединения, содержащие неметаллы в высших положительных степенях окисленности, могут быть окислителями, а соединения, в которых неметалл проявляет отрицательную окисленность, - восстановителями.
К широко применяемым в промышленности восстановителям относятся водород, углерод (в виде угля или кокса) и монооксид углерода СО.
К сильным окислителям принадлежат неметаллы верхней части VI и VII групп периодической системы. Сильные окислительные свойства этих веществ объясняются большой электроотрицательностью их атомов. Сильнее всего окислительные свойства выражены у фтора, но в практике чаще пользуются в качестве окислителей кислородом, хлором и бромом.
К соединениям, применяемым в качестве окислителей, относятся также кислоты. Наибольшее практическое значение имеют соляная, серная и азотная кислоты.
- 262 -
При этом элементом окислителем в соляной кислоте является водород, в азотной — азот, в разбавленной серной — водород, в концентрированной — сера. Поэтому уравнение процесса восстановления соляной и разбавленной серной кислот имеет вид:
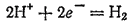
Азотная кислота, в зависимости от ее концентрации, температуры и природы восстановителя, может восстанавливаться до различных степеней окисленности азота (см. § 142). Одним из обычных продуктов ее восстановления является оксид азота NO:
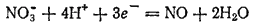
При восстановлении концентрированной серной кислоты также могут образовываться различные продукты (см. § 130). Одним из них может быть диоксид серы:
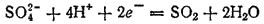
Из других соединений неметаллов, применяемых в качестве окислителей, можно указать на пероксид водорода, соли кислот, в которых кислотообразующий элемент проявляет высокую степень окисленности — хлораты (KClO3), перхлораты (KClO4).
| <<< Назад 95. Составление уравнений окислительно-восстановительных реакций. |
Вперед >>> 97. Окислительно-восстановительная двойственность. |
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Глава 3. ВАЖНЕЙШИЕ АБИОТИЧЕСКИЕ ФАКТОРЫ И АДАПТАЦИИ К НИМ ОРГАНИЗМОВ
- 182. Каковы важнейшие физико-химические свойства воды?
- Важнейшие достижения в освоении космоса с 1957 года
- Глава 2 Возвращение Эйнштейна в детство Важнейшие вопросы о времени очень просты…
- 15. Важнейшие классы и номенклатура неорганических веществ.
- Важнейшие открытия и достижения молекулярной генетики
- 97. Окислительно-восстановительная двойственность.
- 95. Составление уравнений окислительно-восстановительных реакций.
