Книга: Покоренный электрон
Химическое действие тока
| <<< Назад Появляются новые термины |
Вперед >>> Переправа электрических путешественников |
Химическое действие тока
Фарадей начал исследовать электролиз, повторяя опыты своих предшественников. Он разлагал электрическим током слегка подкисленную воду. Частицы воды при этом распадались на водород и кислород. Кислород собирался на аноде, водород — на катоде.
Чтобы эти газы во время опыта не улетучились, ученый надел на катод и на анод опрокинутые пробирки, заполненные водой. Пузырьки газов, отрываясь от электродов, подымались вверх и, вытесняя воду, скапливались под донышками пробирок. Это несложное приспособление позволяло измерять, сколько газов выделяется при электролизе (рис. 30).
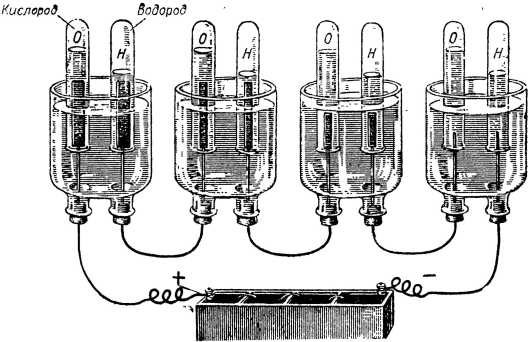
Рис. 30. Размер и форма электродов не влияют на количество газов, выделившихся при электролизе.
После первых опытов у Фарадея зародилось предположение, что количество выделившихся газов зависит только от того, сколько тока было пропущено через электролит. Но прежде чем проверять свою догадку, Фарадей решил узнать, какое значение имеют размеры электродов. Он взял четыре одинаковые стеклянные банки и заполнил их слабым раствором серной кислоты. В первую банку Фарадей опустил самые большие пластинки, во вторую— поменьше, в третью — еще меньше, а в четвертую — тонкие короткие проволочки.
Все четыре банки Фарадей соединил проводами последовательно. Ток из первой банки переходил во вторую, из второй в третью, а из третьей — в четвертую. При таком соединении через каждую из банок проходит совершенно одинаковое количество электричества.
Фарадей присоединил провода к батарее и стал наблюдать. В пробирках побежали пузырьки газов.
Прошло десять минут, — водорода во всех банках выделилось поровну (то же можно было сказать и о количестве кислорода); ученый подождал еще 5 минут, — равенство не нарушилось, и на 25-й минуте опыта количество водорода во всех банках продолжало увеличиваться совершенно равномерно. Размеры электродов влияния на количество разложившегося вещества не оказывали.
За первым опытом последовали другие. Фарадей менял силу тока, концентрацию раствора кислоты, расстояние между электродами, но количество водорода всегда неизменно оставалось пропорциональным количеству электричества, пропущенного через электролит.
В последнем опыте Фарадей применил электроды одинакового размера и формы, но изготовленные из разных материалов. Катоды были платиновые, а аноды — один цинковый, другой — серебряный, третий — платиновый.
Банки, как и в первом опыте, были соединены последовательно. В результате оказалось, что водорода выделилось во всех банках поровну, а именно: 1 грамм (11,2 литра) на каждые 96500 кулонов электричества.[3]
Закон, найденный в опытах с водой, Фарадей стал проверять на других веществах. Он разлагал током соединение хлора с медью. Пропустив 96500 кулонов, получил на аноде 35,5 грамма (тоже 11,2 литра!) хлора, а на катоде 32 грамма меди.
При разложении раствора медного купороса 96500 кулонов электричества тоже выделяли 32 грамма меди.
Эти числа остаются неизменными. Любое химическое соединение, содержащее хлор, выделяет 35,5 грамма хлора на 96500 кулонов электричества. Любое вещество, содержащее медь, выделяет 32 грамма меди притом же количестве электричества.
Числа, полученные Фарадеем, свидетельствовали о неразрывно прочной связи между количеством пропущенного через электролит электричества и количеством выделившегося вещества. Это был незыблемый закон.
Фарадей записал свои выводы примерно так:
1. Количество выделяющихся на электродах веществ прямо пропорционально количеству электричества, пропущенного через электролит.
2. Вес порции каждого вещества, выделяющегося при электролизе на каждые 96500 кулонов, неизменен и зависит только от химических свойств этих веществ, то есть водорода — выделяется 1 грамм, кислорода — 8 граммов, меди — 32 грамма, серебра— 108 граммов и так далее.
| <<< Назад Появляются новые термины |
Вперед >>> Переправа электрических путешественников |
- Творец подлинной науки
- Героическая смерть Рихмана
- Движение мельчайших частичек
- Батарея академика Петрова
- Ток проходит через газ
- По стопам великого Ломоносова
- Единство магнитных и электрических явлений
- Через неудачи к победе
- Магнитное поле электрического тока
- Движения магнита рождают ток
- Теория Фарадея встречает возражения
- Решительное слово Ленца
- Появляются новые термины
- Химическое действие тока
- Переправа электрических путешественников
- Разница электрических уровней
- Электротехнические меры
- Химическое оружие
- 2. Взаимодействие вирусов с клеткой хозяина
- § 67. Воздействие на организмы некоторых экологических факторов
- 13. Даже простое поведение может видоизменяться под действием обучения
- § 77. Антропогенное воздействие на природные экосистемы
- § 68. Взаимодействие факторов. Ограничивающий фактор
- Передача гормонального сигнала: синтез, секреция, транспорт гормонов, их действие на клетки-мишени и инактивация
- Взаимодействие эндокринных систем: прямая связь, обратная связь, синергизм, пермиссивное действие, антагонизм
- Пластичность головного мозга: воздействие окружающей среды
- Глава 13. Действие на расстоянии
- Взаимодействие локусов А и Е
- Сильное и слабое взаимодействие.
