Книга: Общая химия
104. Электрохимическая поляризация.
| <<< Назад 103. Электролиз в промышленности. |
Вперед >>> Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ |
104. Электрохимическая поляризация.
Перенапряжение. Когда электрод находится при потенциале, равном равновесному, на нем устанавливается электрохимическое равновесие:
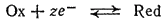
При смещении потенциала электрода в положительную или в отрицательную сторону на нем начинают протекать процессы окисления или восстановления. Отклонение потенциала электрода от его равновесного значения называется электрохимической поляризацией или просто поляризацией.
Поляризацию можно осуществить включением электрода в цепь постоянного тока. Для этого необходимо составить электролитическую ячейку из электролита и двух электродов — изучаемого и вспомогательного. Включая ее в цепь постоянного тока, можно сделать изучаемый электрод катодом или (при обратном включении ячейки) анодом. Такой способ поляризации называется поляризацией от внешнего источника электрической энергии.
Рассмотрим простой пример поляризации. Пусть медный электрод находится в 0,1 m растворе CuSO4, не содержащем никаких примесей, в том числе растворенного кислорода. Пока цепь не замкнута, потенциал электрода при 25°C будет иметь равновесное значение, равное
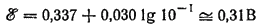
а на границе металла с раствором установится электрохимическое равновесие:
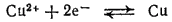
Подключим электрод к отрицательному полюсу источника тока — сделаем его катодом. Избыток электронов, который появится теперь на электроде, сдвинет потенциал электрода в отрицательную сторону и одновременно нарушит равновесие. Электроны будут притягивать катионы меди из раствора — пойдет процесс восстановления:
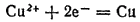
Если подключить электрод не к отрицательному, а к положительному полюсу источника тока — сделать его анодом, то вследствие удаления части электронов потенциал электрода сместится в положительную сторону и равновесие также нарушится. Но теперь на электроде будет протекать процесс окисления, так как в ходе этого процесса высвобождаются электроны:
- 294 -
Таким образом, поляризация электрода в отрицательную сторону связана с протеканием процесса восстановления, а поляризация в положительную сторону — с протеканием процесса окисления. Процесс восстановления иначе называют катодным процессом, а процесс окисления — анодным. В связи с этим поляризация в отрицательную сторону называется катодной поляризацией, а в положительную — анодной.
Другой способ поляризации электрода — это контакт его с электрохимической системой, электродный потенциал которой имеет более положительное или более отрицательное значение, чем потенциал рассматриваемого электрода.
Рассмотрим работу медно-цинкового гальванического элемента. При разомкнутой цепи как на медном, так и на цинковом электродах устанавливаются электрохимические равновесия. Но электродные потенциалы, отвечающие этим равновесиям, различны. В случае 0,1 т растворов они равны:
При замыкании цепи оба электрода оказывают друг на друга поляризующее действие: потенциал медного электрода под влиянием контакта с цинком сдвигается в отрицательную сторону, а потенциал цинкового электрода под влиянием контакта с медью — в положительную. Иначе говоря, медный электрод поляризуется катодно, а цинковый — анодно. Одновременно на обоих электродах нарушаются электрохимические равновесия и начинают протекать электрохимические процессы: катодный процесс на медном электроде и анодный — на цинковом:

Поляризация электрода — необходимое условие протекания электродного процесса. Кроме того, от ее величины зависит скорость электродного процесса: чем сильнее поляризован электрод, тем с большей скоростью протекает на нем соответствующая полуреакция.
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный (при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного Процесса с определенной скоростью, называется перенапряжением данного электродного процесса. Таким образом, перенапряжение выделения водорода на различных металлах различно.
В табл. 20 приведены для 1 н. растворов величины катодной поляризации, которую необходимо осуществить на электроде для выделения на нем водорода со скоростью 0,1 мл в минуту с 1 см2 рабочей поверхности электрода.
- 295 -
Таблица 20. Перенапряжение выделения водорода на различных металлах

Выяснение связи между величиной поляризации и скоростью электродного процесса является важнейшим методом изучения электрохимических процессов. При этом результаты измерений обычно представляют в виде поляризационных кривых — кривых зависимости плотности тока на электроде от величины поляризации. Вид поляризационной кривой того или иного электродного процесса отражает особенности его протекания. Методом поляризационных кривых изучают кинетику и механизм окислительно-восстановительных реакций, работу гальванических элементов, явления коррозии и пассивности металлов, различные случаи электролиза.
Большой вклад в развитие кинетики электродных процессов и теории перенапряжения внес советский ученый А. Н Фрумкин.
| <<< Назад 103. Электролиз в промышленности. |
Вперед >>> Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ |
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
