Книга: Удивительный мир органической химии
3.3. Всем известный ацетилен
| <<< Назад 3.2. Всегда ли двойная связь прочнее? |
Вперед >>> Глава 4 Молекулы-циклы |
3.3. Всем известный ацетилен
Углеродные атомы могут соединяться между собой не только с помощью двойной связи, но и тройной. Самым простым углеводородом, содержащим тройную связь, является известный многим газ — ацетилен. Этот газ бесцветен, не имеет запаха. Однако при его получении из карбида кальция (а именно так получают ацетилен в технике) образуются газообразные примеси (РН3, H2S, NH3), которые придают ацетилену типичный «карбидный запах». Наверное, многие его ощущали в тех местах, где занимаются сваркой или резкой металлов. Ацетилен при горении в кислороде создает высокотемпературное пламя (свыше 3000 °С). Это и используют в технике. Кстати, ацетилен для автогенной сварки начали использовать еще в 1906 г. в США. Смеси ацетилена с кислородом или воздухом взрывоопасны, поэтому ацетилен хранят и транспортируют в специальных баллонах.
Впервые об ацетилене узнали в 1836 г., когда он был получен при действии воды на карбид кальция (СаС2). Но в 1862 г. этот газ уже был синтезирован М. Бертло при пропускании водорода через электрическую дугу между двумя угольными электродами (т. е. из элементов — углерода и водорода). Этот же ученый определил его состав (С2Н2) и дал этому газу название — ацетилен. Кроме того, он предположил, что ацетилен является первым углеводородом, образующим гомологический ряд с общей формулой СnН2n-2.
Итак, молекула ацетилена состоит из двух атомов углерода и двух водородных атомов. Следовательно, чтобы соблюсти четырехвалентность атома углерода, формулу ацетилена следует записать так:
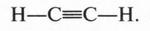
Ацетилен — самое простое органическое соединение с тройной связью между углеродными атомами. Как же устроена такая связь?
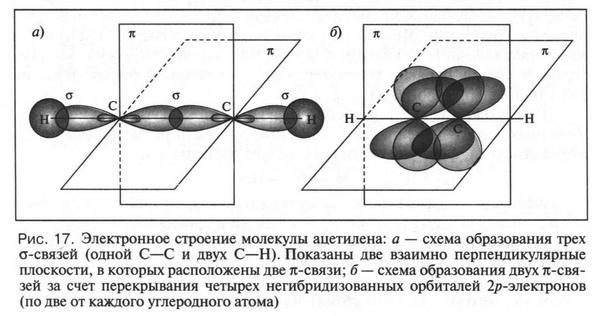
Для объяснения снова обратимся к теории гибридизации. Согласно этой теории атом углерода в молекуле ацетилена находится в состоянии sp-гибридизации. Перекрыванием двух sp-гибридных орбиталей (по одной от каждого углеродного атома) образуется одна связь между углеродными атомами. Это — ?-связь, которую в формулах обозначаем одной черточкой. Две другие sp-гибридные орбитали (также по одной от каждого углеродного атома) образуют с 1s-орбиталями двух водородных атомов две ?-связи С—Н. Они расположены друг относительно друга под углом 180°. Но у каждого углеродного атома остались еще по две негибридизованные 2р-орбитали! Вот они-то, перекрываясь в двух взаимно перпендикулярных плоскостях, и образуют две ?-связи. В формуле они обозначены еще двумя черточками. Обратите внимание, что перекрывание 2p-орбиталей, как в случае этилена, происходит «боками», а не «лбами». Поэтому прочность образовавшихся ?-связей незначительна. Как видно из рисунка 17, молекула ацетилена имеет линейное строение. Таким образом, символ из трех черточек в формуле молекулы ацетилена означает сочетание одной ?-связи и двух ?-связей.
Поскольку мы уже знаем строение одинарной, двойной и тройной связей, давайте сравним их длины. Не может быть, чтобы эти связи не отличались по длине. Действительно, рентгеноструктурный анализ показал, что длина простой связи равна 0,154 нм (1 нм = 10-7 см), двойной — 0,134 нм, а тройной — 0,120 нм. Таким образом, длина тройной связи — самая короткая.
Мы уже знаем, что впервые ацетилен получили из карбида кальция. Вот схема этой реакции:
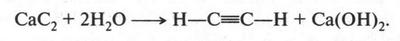
Этим способом и сейчас получают ацетилен в технике. Для этого карбид кальция «выпекают» в электропечах при прокаливании кокса с негашеной известью при температуре 2500 °С:
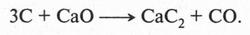
Интересно, что впервые карбид кальция был получен еще в 1892 г. (уже специально для получения ацетилена) французским химиком Анри Муассаном (1852-1907).
Сейчас ацетилен в промышленности получают разложением метана при температуре 1500 °С:
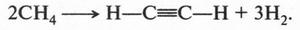
Как оказалось, этим способом ацетилен получил М. Бертло еще в 1868 г. Тогда же он высказал мысль о том, что такой путь может оказаться перспективным. Что ж, ученый оказался прав: в 1936 г. в Германии и США ацетилен стали получать термическим разложением метана.
Ацетилен, как соединение непредельное, легко вступает в реакции присоединения со многими веществами. Например, при гидрировании (присоединение водорода) в присутствии катализатора вначале образуется этилен (разрывается одна ?-связь), а затем — этан (разрывается вторая ?-связь):
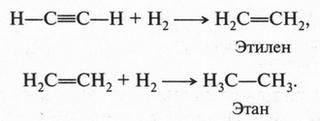
Подобным образом происходит и присоединение галогенов. Вначале образуется дигалогенопроизводное, а затем — тетрагалогенопроизводное. Например:
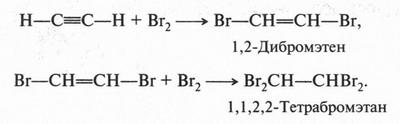
Но есть еще одна интересная реакция ацетилена. При действии на него аммиачного раствора оксида серебра получают ацетиленид серебра — продукт замещения водородных атомов на серебро.
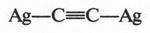
Это желтоватое вещество в сухом состоянии способно взрываться от удара. Ацетиленид серебра формально напоминает соль, но не следует думать, что ацетилен — кислота. Дело в том, что водородные атомы в молекуле ацетилена немного «подвижнее», чем в молекуле этилена, а тем более — в молекуле этана. Поэтому ацетиленовые водороды замещаются на атомы серебра. Впервые ацетиленид серебра получил в 1866 г. М. Бертло, но еще раньше, в 1860 г., он обратил внимание на другую реакцию — взаимодействие ацетилена с водой. В результате этой реакции ученый получил уксусный альдегид.
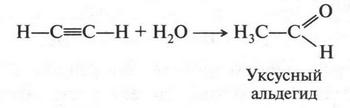
Позже эту реакцию начал изучать известный русский химик Михаил Григорьевич Кучеров (1850-1911). В качестве катализатора он использовал соли ртути. Как установил ученый, при гидратации гомологов ацетилена можно получать кетоны (соединения, в которых карбонильная группа связана с двумя радикалами). Например:
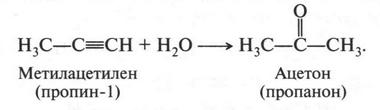
«Реакция Кучерова» нашла широкое практическое применение. В некоторых странах (Германия, Италия, Англия, Франция и др.) получение уксусного альдегида было начато еще в 1914-1916 гг. Получают его по этой реакции и в нашей стране.
Ацетилен обладает одной интересной особенностью. В 1866 г. М. Бертло удалось получить из ацетилена бензол.
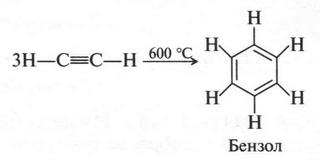
Так была установлена генетическая связь между ацетиленом и бензолом. Однако бензол получался в незначительных количествах. В 1924 г. академик Николай Дмитриевич Зелинский (1861-1953), применив в качестве катализатора активированный уголь, превратил эту реакцию в промышленный метод получения бензола.
Но, как оказалось, ацетилен при циклизации может дать и другие циклические соединения:
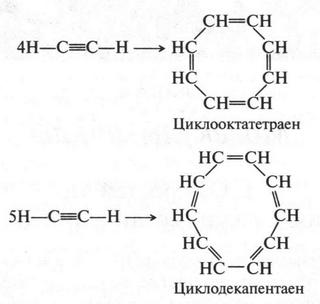
Используют ацетилен и для получения различных полимерных продуктов.
При действии окислителей ацетилен легко окисляется. При этом происходит разрыв молекулы по месту тройной связи. Такую реакцию легко наблюдать, если ацетилен пропускать через водный раствор перманганата калия (марганцовку). В результате раствор быстро обесцвечивается. Эта реакция, как видите, является качественной не только на двойную связь, но и тройную.
При полном сгорании ацетилен образует оксид углерода (IV) и воду:
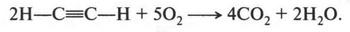
Но при неполном сгорании можно получить углерод (сажу):
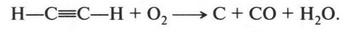
Вот такими свойствами обладает этот газ — всем известный ацетилен. Его значение в химии настолько огромно, что существует даже отдельная химическая наука — химия ацетилена.
| <<< Назад 3.2. Всегда ли двойная связь прочнее? |
Вперед >>> Глава 4 Молекулы-циклы |
