Книга: Общая химия
122. Кислородсодержащие соединения галогенов.
| <<< Назад 121. Соединения галогенов с водородом. |
Вперед >>> Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ |
122. Кислородсодержащие соединения галогенов.
Галогены образуют ряд соединений с кислородом. Однако все эти соединения неустойчивы, не получаются при непосредственном взаимодействии галогенов с кислородом и могут быть получены только косвенным путем. Такие особенности кислородных соединений галогенов согласуются с тем, что почти все они характеризуются положительными значениями стандартной энергии Гиббса образования (см., например, в табл. 7 на стр. 194 значения ?G°298 для ClO2, Cl2O, Cl2O7 и OF2).
Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее— оксиды и кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисленности, достигающую семи.
Фторид кислорода OF2 можно получить пропусканием фтора в охлажденный 2% раствор NaOH. Реакция идет согласно уравнению:
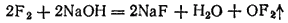
Помимо OF2 при этом всегда образуются кислород, озон и пероксид водорода. При обычных условиях OF2 — бесцветный газ с резким запахом озона. Фторид кислорода очень ядовит, проявляет сильные окислительные свойства и может служить одним из эффективных окислителей ракетных топлив.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
Как уже указывалось, кислородные соединения хлора могут быть получены только косвенными методами. Рассмотрение путей их образования начнем с процесса гидролиза хлора, т. е. с обратимой реакции между хлором и водой
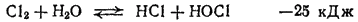
в результате которой образуются соляная кислота и хлорноватстая кислота HOOCl.
- 354 -
Гидролиз хлора является реакцией самоокисления-самовосстановления, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется.
Получающиеся при гидролизе хлора HCl и HOCl могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается, когда прореагирует приблизительно 1/3 растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Cl2 значительное количество соляной и хлорноватистой кислот.
Хлорноватистая кислота HOCl — очень слабая кислота ( K = 5·10-8 ), более слабая, чем угольная; соли ее называются гипохлоритами. Будучи весьма нестойким соединением, хлорноватистая кислота даже в разбавленном растворе постепенно распадается (см. ниже).
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие в системе
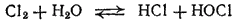
сдвигается вправо; реакция практически доходит до конца и получается раствор, содержащий соли хлорноватистой и соляной кислот:
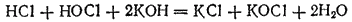
Тот же результат получится, если непосредственно пропускать хлор в холодный раствор щелочи
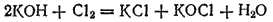
или в ионно-молекулярной форме:
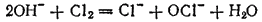
Полученный таким путем раствор солей хлорноватистой и соляной кислот применяется для беления; его белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже при действии диоксида углерода, находящегося в воздухе, причем образуется хлорноватистая кислота:
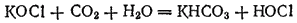
Последняя и обесцвечивает красящие вещества, окисляя их.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор гидроксида натрия. Оба раствора можно получить электролизом растворов хлоридов калия или натрия, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами (см, стр. 549).
- 355 -
При действии хлора на сухую гашеную известь получается так называемая белильная, или хлорная, известь. Главной ее составной частью является соль CaOCl2, образующаяся согласно уравнению:
Ca(OH)2 + Cl2 = CaOCl2 + H2O
Этой соли отвечает структурная формула
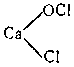
Хлорная известь представляет собой белый порошок с резким запахом и обладает сильными окислительными свойствами. Во влажном воздухе под действием диоксида углерода она постепенно разлагается, выделяя хлорноватистую кислоту:
2CaOCl2 + CO2 + H2O = CaCO3 + CaCl2 +2HOCl
При действии на хлорную известь соляной кислоты выделяется хлор:
CaOCl2 + 2HCl = CaCl2 + Cl2 + H2O
Хлорная известь применяется для отбелки растительного волокна (тканей, бумаги) и для дезинфекции.
В растворе хлорноватистая кислота испытывает три различных типа превращений, которые протекают независимо друг от друга:
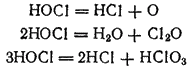
Изменяя условия, можно добиться того, что реакция пройдет практически нацело по какому-нибудь одному направлению.
Под действием прямого солнечного света и в присутствии некоторых катализаторов или восстановителей разложение хлорноватистой кислоты протекает согласно уравнению (1).
Реакция (2) идет в присутствии водоотнимающнх средств, например CaCl2. В результате реакции получается оксид хлора(I) (хлорноватистый ангидрид) Cl2O, представляющий собой крайне неустойчивый желто-бурый газ с запахом, похожим на запах хлора.
Распад HOCl согласно реакции (3) особенно легко идет при нагревании. Поэтому, если пропускать хлор в горячий раствор гидроксида калия, то вместо KClO сразу получается KClO3:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Продуктами реакции являются хлорид калия и хлорит калия KClO3 — соль хлорноватой кислоты HClO3. Поскольку хлорат калия (или бертолетова соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
- 356 -
Соответствующая хлоратам хлорноватая кислота известна только в виде водного раствора с концентрацией не выше 50%. Она проявляет свойства сильной кислоты (приблизительно равной по силе HCl и HNO3) и сильного окислителя. Так, концентрированные ее растворы воспламеняют дерево.
В противоположность свободной HClO3, у хлоратов окислительные свойства в растворе выражены слабо. Большинство из них хорошо растворимы в воде; все они ядовиты. Наибольшее применение из хлоратов находит KClO3, который при нагревании легко разлагается. В присутствии MnO2 (в качестве катализатора) разложение в основном протекает согласно уравнению:
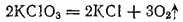
С различными горючими веществами (серой, углем, фосфором) KClO3 образует смеси, взрывающиеся при ударе. На этом основано его применение в артиллерийском деле для устройства запалов. Хлорат калия употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главный же потребитель хлората калия — спичечная промышленность. В головке обычной спички содержится около 50% KClO3.
Ангидрид хлорноватой кислоты неизвестен. При действии концентрированной серной кислоты KClO3 вместо него выделяется желто-бурый газ с характерным запахом — диоксид (или двуокись) хлора ClO2. Это очень неустойчивое соединение, которое при нагревании, ударе или соприкосновении с прочими веществами легко разлагается со взрывом на хлор и кислород.
Диоксид хлора применяют для отбелки или стерилизации различных материалов (бумажной массы, муки и др.).
При взаимодействии ClO2 с раствором щелочи медленно протекает реакция
2ClO2 +2KOH = KClO3 +KClO2 + H2O
с образованием солен двух кислот — хлорноватой HClO3 и хлористой HClO2.
Хлористая кислота мало устойчива. По силе и окислительной активности она занимает промежуточное положение между HOCl и HClO3. Соли ее - хлориты используются при отбелке тканей.
При осторожном нагревании хлората калия без катализатора его разложение протекает в основном согласно схеме:
4KClO3 = 3KClO4 + KCl
Образующийся перхлорат калия KClO4 очень мало растворим в воде и поэтому может быть легко выделен.
Действием концентрированной серной кислоты на KClO4 может быть получена свободная хлорная кислота HClO4, представляющая собой бесцветную, дымящую на воздухе жидкость.
Безводная HClO4 малоустойчива и иногда взрывается при хранении, но ее водные растворы вполне устойчивы. Окислительные свойства HClO4 выражены слабее, чем у HClO3, а кислотные свойства— сильнее. Хлорная кислота — самая сильная из всех известных кислот.
- 357 -
Соли HClO4, за немногими исключениями, к которым относится и KClO4, хорошо растворимы и в растворе окислительных свойств не проявляют.
Если нагревать хлорную кислоту с P2O5, отнимающим от нее воду, то образуется оксид хлора(VII), или хлорный ангидрид, Cl2O7
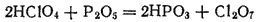
Оксид хлора(VII) - маслянистая жидкость, кипящая с разложением при 80°C. При ударе или при сильном нагревании Cl2O7 взрывается.
Изменение свойств в ряду кислородных кислот хлора можно выразить следующей схемой:

С увеличением степени окисленности хлора устойчивость его кислородных кислот растет, а их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота.
Напротив, сила кислородных кислот хлора возрастает с увеличением его степени окисленности. Из всех гидроксидов хлора самая слабая кислота — хлорноватистая, самая сильная — хлорная. Такая закономерность — усиление кислотных свойств гидроксида (и, соответственно, ослабление его основных свойств) с ростом степени окисленности элемента характерна не только для хлора, но и для других элементов. В первом приближении эту закономерность можно объяснить, рассматривая все химические связи в молекулах гидроксидов как чисто ионные.
На рис. 108 схематически изображена часть молекулы гидроксида Э(OH)n, составленная из n-зарядного иона Эn+, иона кислорода O2- и иона водорода (протона) H+. Диссоциация этой части молекулы на ионы может происходить либо с разрывом связи Э-О (в результате чего отщепляется OH-), либо с разрывом связи O-H (что приводит к отщеплению иона H+); в первом случае гидроксид будет проявлять свойства основания, во втором — свойства кислоты.
Каждый из возможных путей диссоциации гидроксида будет осуществляться тем легче, чем слабее связь между соответствующими ионами. При возрастании степени окисленности элемента Э увеличится заряд иона Эn+, что усилит его притяжение к иону O2- и тем самым затруднит диссоциацию гидроксида по типу основания.
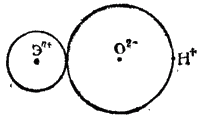
Рис. 108. Ионная схема фрагмента молекулы гидроксида Э(OH)n
- 358 -
Вместе с тем усилится взаимное отталкивание одноименно заряженных ионов Эn+ и H+, что облегчит диссоциацию по кислотному типу. Таким образом, с увеличением степени окисленности элемента усиливаются кислотные свойства и ослабевают основные свойства образуемого этим элементом гидроксида.
Увеличение радиуса иона Эn+ при неизменном его заряде приведет к возрастанию расстояний между центром этого иона и центрами ионов O2- и H+. В результате взаимное электростатическое притяжение ионов Эn+ и O2- станет более слабым, что облегчит диссоциацию по основному типу; одновременно уменьшится взаимное отталкивание ионов Эn+ и H+, так что диссоциация по кислотному типу затруднится. Следовательно, с возрастанием радиуса иона элемента (при неизменном его заряде) усиливаются основные свойства и ослабляются кислотные свойства образуемого этим элементом гидроксида. Примером проявления этой закономерности может служить изменение констант кислотной диссоциации в ряду HOCl(K=5·10-8)-HOBr (K=2·10-9) - HOI (K=2·10-10).
Разумеется, предположение о чисто ионной природе химических связей в молекулах гидроксидов является весьма грубым. В действительности связь O-H имеет преимущественно ковалентный характер, а связь Э-O можно считать близкой к ионной только для щелочных металлов. Кроме того, изложенная трактовка кислотно-основных свойств гидроксидов не учитывает особенностей взаимодействия ионов ЭO-, H+, Эn+ и OH- с молекулами растворителя (воды). Поэтому рассмотренная схема влияния заряда и размеров иона Эn+ на характер диссоциации молекулы Э(OH)n не может служить основой для количественной оценки кислотноосновных свойств гидроксидов. Однако при сопоставлении кислотно-основных свойств различных гидроксидов, образуемых данным элементом в разных состояниях его окисленности, или при сопоставлении свойств аналогичных гидроксидов, образуемых элементами одной и той же подгруппы периодической системы, эта схема в большинстве случаев приводит к правильным качественным выводам.
Кислородные соединения брома и иода. Растворы бромноватистой (НОВг) и иодноватистой (HOI) кислот могут быть получены, подобно хлорноватистой кислоте, взаимодействием соответствующих галогенов с водой
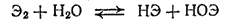
причем в ряду Cl2 - Br2 - I2 равновесие все в большей степени смещается влево.
При переходе от HOCl к НОВг и HOI устойчивость и окислительная активность кислот уменьшаются. По этому же ряду ослабляются и кислотные свойства (см. выше). Иодноватистая кислота HOI является уже амфотерным соединением, у которого основные свойства несколько преобладают над кислотными.
Бромноватую (HBrO3) и йодноватую (HIO3) кислоты можно получить путем окисления бромной или йодной воды хлором:
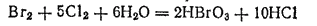
- 359 -
Бромноватая кислота очень похожа по свойствам на HClO3, а окислительные и кислотные свойства HIO3 выражены значительно слабее.
Иодноватая кислота представляет собой бесцветные кристаллы, вполне устойчивые при комнатной температуре. При осторожном нагревании ее до 200°C можно получить порошок оксида иода(V), или йодноватого ангидрида — I2O5:
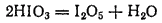
Йодноватый ангидрид проявляет окислительные свойства, а при нагревании выше 300°C распадается на иод и кислород.
До недавнего времени считали, что бром не образует соединений, в которых его степень окисленности равна семи. Однако в 1968 г. путем окисления KBrO3 были получены перброматы и соответствующая им бромная кислота HBrO4. Наилучшим окислителем оказался XeF2:
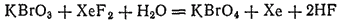
О свойствах бромной кислоты и ее солей пока известно мало. Напротив, йодная кислота (HIO4) и ее соли (периодаты) хорошо изучены.
Сама кислота может быть получена действием иода на HClO4
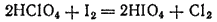
или электролизом раствора HIO3:
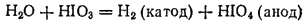
Из раствора йодная кислота выделяется в виде бесцветных кристаллов, имеющих состав HIO4·2H2O. Этот гидрат следует рассматривать как пятиосновную кислоту H5IO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5IO6). Йодная кислота — слабая, но более сильный окислитель, чем HClO4.
Оксид иода (VII) I2O7 не получен.
| <<< Назад 121. Соединения галогенов с водородом. |
Вперед >>> Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ |
- § 58 Соединения, необходимые для существования жизни: белки, липиды
- § 56 Высокомолекулярные соединения
- § 57 Соединения, необходимые для существования жизни: нуклеиновые кислоты, полисахариды
- § 55 Циклические органические соединения
- Органические соединения в космосе
- 910. Почему не следует сбрасывать в океан азотистые и фосфатные соединения, а также органические вещества?
- 3.2. Комплексные соединения и живое вещество
- 2.35. АВГУСТ КЕКУЛЕ, БЕНЗОЛЬНОЕ КОЛЬЦО И АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- 119. Химические свойства галогенов.
- 242. Химические свойства железа. Соединения железа.
- 134. Соединения серы с галогенами.
