Книга: Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы
Главная молекула жизни
| <<< Назад Преджизнь |
Вперед >>> Оболочка |
Главная молекула жизни
Общепринятого определения жизни не существует (в биологии вообще с определениями трудно — обычно чем строже определение, тем хуже оно работает). Одни ученые полагают, что жизнь — скорее процесс, чем структура, и определяют ее, например, как «процесс сохранения неравновесного состояния органической системы извлечением энергии из среды». Такому определению могут соответствовать и системы, не имеющие четких пространственных границ, — автокаталитические циклы, «живые растворы». Другие подчеркивают обязательную дискретность живых объектов и считают, что понятие «жизнь» неотделимо от понятия «организм». Третьи подчеркивают информационную природу жизни и определяют ее как способность некого фрагмента информации («репликатора») к самокопированию с использованием ресурсов внешней среды. Под это определение подходят не только биологические вирусы, но и компьютерные и даже распространяющиеся в обществе слухи, верования и т. п.[14] Но это, пожалуй, чересчур широкий взгляд на жизнь.
Нам известна только одна жизнь — земная, и мы не знаем, какие из ее свойств являются обязательными для любой жизни вообще. Рискнем, однако, два таких свойства все-таки назвать. Это, во-первых, наличие наследственной информации, во-вторых — активное осуществление функций, направленных на самоподдержание и размножение, а также на получение энергии, необходимой для выполнения всей этой работы.
Все живое на Земле справляется с перечисленными задачами при помощи трех классов сложных органических соединений: ДНК, РНК и белков[15]. ДНК взяла на себя первую задачу — хранение наследственной информации. Белки отвечают за вторую: они выполняют все виды активных «работ». Разделение труда у них очень строгое. Белки не хранят наследственную информацию, ДНК не совершает активной работы (в биологии почти не бывает правил без исключений, в данном случае исключения тоже есть, но очень редкие и не делающие погоды).
Молекулы третьего класса веществ — РНК — служат посредниками между ДНК и белками, обеспечивая считывание наследственной информации. При помощи РНК осуществляется синтез белков в соответствии с записанными в молекуле ДНК «инструкциями». Некоторые из функций, выполняемых РНК, очень похожи на функции белков (активная работа по прочтению генетического кода и синтезу белка), другие напоминают функции ДНК (хранение и передача информации). И все это РНК делает не в одиночку, а при активном содействии со стороны белков. На первый взгляд РНК кажется «третьей лишней». В принципе нетрудно представить себе организм, в котором РНК вовсе нет, а все ее функции поделили между собой ДНК и белки. Правда, таких организмов в природе не существует.
—————
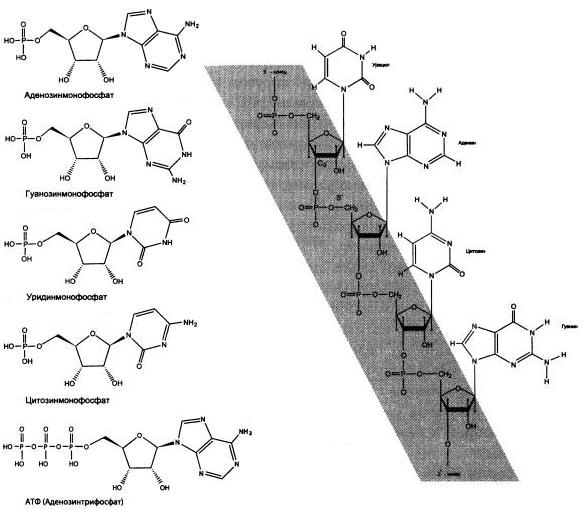
РНК — полимер, состоящий из множества похожих «кирпичиков» — рибонуклеотидов, каждый из которых, в свою очередь, собран из трех частей. Первая из них — фосфорная кислота (фосфат), неорганическое вещество, которого довольно много в земной коре и океанах. Вторая — азотистое основание. В состав РНК входят четыре азотистых основания: А (аденин), У (урацил), Г (гуанин) и Ц (цитозин); соответственно, существует четыре вида рибонуклеотидов. Азотистые основания могли синтезироваться из неорганических молекул (таких как CO, HCN и NH3)еще в протопланетном облаке. Их находят и в метеоритах. Третья — сахар рибоза — образуется в ходе автокаталитической реакции Бутлерова.
Четыре составных блока молекулы РНК — нуклеотиды аденозин (аденин + рибоза), гуанозин (гуанин + рибоза), уридин (урацил + рибоза) и цитидин (цитозин + рибоза), к каждому из которых присоединено по одному остатку фосфорной кислоты. АТФ (главная энергетическая молекула живой клетки) представляет собой аденозин с тремя фосфатами.
—————
Какая из трех молекул появилась первой? Одни ученые говорили: конечно, белки, ведь они выполняют всю работу в живой клетке, без них жизнь невозможна. Им возражали: белки не могут хранить наследственную информацию, а без этого жизнь и подавно невозможна! Значит, первой была ДНК!
Ситуация казалась неразрешимой: ДНК ни на что не годна без белков, белки — без ДНК. Получалось, что они должны были появиться вместе, одновременно, а это трудно себе представить. Про «лишнюю» РНК в этих спорах почти забыли. Ведь она, как тогда думали, не может без посторонней помощи ни хранить информацию, ни выполнять работу.
Потом, правда, выяснилось, что у многих вирусов наследственная информация хранится в виде молекул РНК, а не ДНК. Но это посчитали курьезом, исключением. Переворот произошел в 80-х годах XX века, когда были открыты рибозимы — молекулы РНК с каталитическими свойствами. Рибозимы — это РНК, выполняющие активную работу, то есть то, что должны делать белки. Среди рибозимов были найдены и катализаторы репликации (копирования, размножения) молекул РНК — своих собственных или чужих.
В итоге РНК из «почти лишней» стала «почти главной». Оказалось, что она, и только она, может выполнять сразу обе главные жизненные задачи — и хранение информации, и активную работу. Стало ясно, что возможен полноценный живой организм, не имеющий ни белков, ни ДНК, в котором все функции выполняются только молекулами РНК. Конечно, ДНК лучше справляется с задачей хранения информации, а белки — с «работой», но это уже детали. РНК- организмы могли приобрести белки и ДНК позже, а поначалу обходиться без них.
Так появилась теория РНК-мира, согласно которой первые живые существа были РНК-организмами без белков и ДНК. А первым прообразом будущего РНК-организма мог стать автокаталитический цикл, образованный самовоспроизводящимися молекулами РНК — теми самыми рибозимами, которые способны катализировать синтез собственных копий.
Лично я считаю теорию РНК-мира одним из самых выдающихся достижений теоретической мысли в биологии за последние 30 лет, которое можно сравнить разве что с симбио-генетической теорией происхождения эукариот[16] (о которой пойдет речь в главе «Великий симбиоз»). По правде сказать, могли бы до этого додуматься и раньше. Ведь два вида рибозимов были известны еще с 60-х годов XX века, хотя их не называли тогда рибозимами. Это рибосомные РНК (рРНК), из которых сделаны молекулярные «машинки» для трансляции (синтеза белка) — рибосомы, и транспортные РНК (тРНК), которые подносят нужные аминокислоты к рибосомам в ходе трансляции. Оба вида РНК выполняют активную биохимическую работу, это самые настоящие рибозимы, но, пока их было известно только два, теория РНК-мира не была сформулирована.
—————
Трансляция — синтез белка. Осуществляется особыми молекулярными «машинками» — рибосомами, которые состоят из нескольких больших молекул рибосомной РНК и большого числа менее крупных молекул рибосомных белков. Рибосомы синтезируют белок в соответствии с «инструкциями», записанными в молекуле матричной РНК (мРНК). Каждые три нуклеотида мРНК кодируют одну аминокислоту. Аминокислоты присоединяются к синтезируемой молекуле белка по одной. Доставка аминокислот к рибосомам осуществляется транспортными РНК (тРНК).
—————
Теория РНК-мира, вначале чисто умозрительная, очень быстро «обрастает» экспериментальными данными. Химики научились получать рибозимы чуть ли не с любыми желаемыми характеристиками. Делается это так. Например, мы хотим создать молекулу РНК, которая способна безошибочно узнавать вещество X и связываться с ним. Для этого синтезируют большое количество разных цепочек РНК, соединяя рибонуклеотиды друг с другом в случайном порядке. Раствор, содержащий полученную смесь молекул РНК, наливают на поверхность, покрытую веществом X. После этого остается лишь отобрать и исследовать те молекулы РНК, которые прилипли к поверхности. Технология незамысловата, но она действительно работает. Примерно таким способом получены рибозимы, катализирующие синтез нуклеотидов, присоединяющие аминокислоты к РНК и выполняющие множество других биохимических функций. Стирая грань между живым и неживым, уже растут на искусственных средах в лабораториях возмутительнейшие объекты — колонии размножающихся молекул РНК, способные к тому же синтезировать белки (правда, без этих самых белков — ферментов — заставить их расти пока не удается). Весомый вклад в эти исследования вносят ученые из Института химической биологии и фундаментальной медицины (г. Новосибирск) и Института белка (г. Пущино) под руководством академиков В. В. Власова и А. С. Спирина. Любопытно, что многие рибозимы работают лучше всего при низких температурах, иногда даже ниже точки замерзания воды — в крошечных полостях льда, где достигаются высокие концентрации реагентов. Некоторые считают это свидетельством того, что жизнь зарождалась при низких температурах.
Конечно, нельзя сказать, что в теории РНК-мира совсем нет проблем и трудностей. Их очень много. Основная, пожалуй, состоит в том, что большинство рибозимов очень малоэффективны по сравнению со своими белковыми аналогами. Во многих случаях это не принципиально, потому что на ранних этапах становления жизни белков еще не было, рибозимам не с кем было конкурировать, они на тот момент были «последним словом науки и техники». Их эффективности вполне хватало для того, чтобы предоставить химическим циклам, в которых они участвовали как катализаторы, решающее преимущество в скорости. Но некоторые ограничения могли оказаться принципиальными. В первую очередь это относится к вышеупомянутой способности рибозимов катализировать синтез собственных копий. В действительности тут все не так просто и гладко. В ныне живущих организмах таких рибозимов не обнаружено. Методом «искусственной эволюции» (то есть путем синтеза множества случайных последовательностей рибонуклеотидов, последующего отбора удачных вариантов, внесения в них небольших случайных изменений, нового отбора и т. д.) удалось получить рибозимы, которые худо-бедно могут «сшить» друг с другом два рибонуклеотида, но не всякие и не всегда. Осуществить полноценное копирование длинной молекулы РНК (то есть служить настоящими РНК-зависимыми РНК-полимеразами) они не могут. Чтобы изготовить из молекул РНК рибозим, который можно с полным правом назвать РНК-зависимой РНК-полимеразой, ученым пришлось воспользоваться наряду с «искусственной эволюцией» еще и сознательным, разумным планированием. В конце концов это удалось сделать — искомый рибозим был составлен из нескольких разных молекул РНК. Но даже и этот с таким трудом разработанный и изготовленный комплексный рибозим работает из рук вон плохо. В чем же дело?
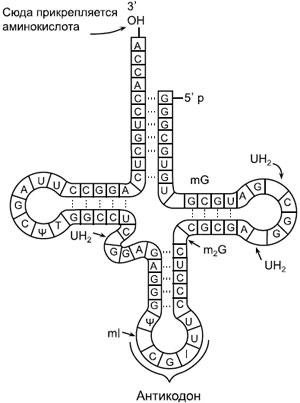
Схема транспортной РНК. A, G, C, U — стандартные нуклеотиды аденозин, гуанозин, цитидин и уридин, другими буквами отмечены нестандартные (модифицированные) нуклеотиды, в том числе I — инозин. Как и многие другие молекулы РНК, тРНК образует петли за счет того, что рибонуклеотиды попарно «склеиваются» друг с другом по принципу комплементарности. Как можно видеть на рисунке, C (цитозин) обычно склеивается с G (гуанином), а A (аденин) — с U (урацилом). Но в биологии, как мы уже знаем, нет правил без исключений: в двух местах этой молекулы, вопреки принципу комплементарности, G соединяется с U.
Не исключено, что дело тут в необходимых кофакторах — ионах металлов, в том числе редких. Известно, что очень многие белковые ферменты используют ионы металлов в качестве своих необходимых составных частей. Такие белки называют металлопротеинами. Похоже, это было справедливо и для рибозимов РНК-мира. До самого недавнего времени эту возможность упускали из виду. Однако недавно было обнаружено, что те самые искусственно полученные рибозимы, которые способны кое-как синтезировать РНК на РНКовой матрице, являются металлорибозимами: в их активном центре присутствует ион магния. Точно так же и проблему взаимодействия РНК с липидными мембранами удалось решить только благодаря объединению РНКовых комплексов с ионами металла, на этот раз — кальция.
Известно, что в древнем океане было гораздо больше, чем теперь, ионов различных тяжелых металлов, в том числе довольно экзотических, таких как вольфрам, молибден или ванадий[17]. Эти ионы до сих пор используются в качестве кофакторов многими белками, особенно у архаичных микроорганизмов. Может быть, дело у исследователей РНК-мира пойдет лучше, если они дадут рибозимам возможность «пользоваться услугами» ионов редких металлов?
—————
У микроба ферроплазмы почти все белки содержат железо. О важной и еще не до конца понятой роли металлов в жизни примитивных клеток свидетельствуют результаты изучения необычного микроба, обнаруженного в 2000 году в биореакторе металлургического завода в Туле.
Этот микроб, относящийся к надцарству архей (Archaea), получил название Ferroplasma acidiphilum. В отличие от большинства других архей и бактерий ферроплазма лишена жесткой клеточной стенки и размножается почкованием.
Ферроплазма живет в очень кислых водах, насыщенных растворенным железом и другими металлами. В природе такие условия встречаются в окрестностях месторождений сульфидных руд (например пирита). Ферроплазма сама производит органику из углекислого газа (подобно растениям), а питаться готовыми органическими веществами не может. В отличие от растений источником энергии для синтеза органики из CO2 ферроплазме служит не солнечный свет, а химическая реакция окисления двухвалентного железа (Fe2+=>Fe3+).

Ферроплазма в процессе почкования (почки показаны стрелками). По фотографии из статьи с первоописанием микроба (O. V. Golyshina et.al., 2000).
В ходе дальнейших исследований у ферроплазмы обнаружилось еще несколько необычных особенностей. В частности, оказалось, что один из ее ферментов (альфа-глюкозидаза) является железосодержащим металлопротеином, в то время как у всех остальных организмов ферменты этого класса никакого железа не содержат. Это побудило команду микробиологов — первооткрывателей ферроплазмы проверить и остальные белки странного микроорганизма на предмет содержания в них железа и других металлов.
Результат оказался более чем удивительным. Из 189 белков, которые ученым удалось выделить из ферроплазмы, лишь 26 не содержали железа. Остальные 163 (86%) оказались железосодержащими металлопротеинами. Самое удивительное, что аналоги большинства из этих белков, встречающиеся у других организмов, не содержат железа.
Железо в белках ферроплазмы не является какой-то необязательной или второстепенной примесью. Исследователи показали, что аккуратное удаление железа из этих белков приводит к сильному изменению их структуры (денатурации) и потере функциональной активности. Похоже на то, что почти все белки ферроплазмы, по образному выражению авторов статьи, держатся на «железных заклепках».
Естественно, сразу возник вопрос о причинах такого обилия железосодержащих металлопротеинов у ферроплазмы. Возможно, это общее свойство всей группы микроорганизмов, к которой относится ферроплазма? Или, может быть, оно характерно именно для микробов, обитающих в кислых, насыщенных растворенным железом водах? Для ответа на этот вопрос исследователи выделили теми же методами металлосодержащие белки из ближайшего родственника ферроплазмы — архей Picrophilus torridus, а также из неродственного, но обитающего в таких же условиях микроорганизма — бактерии Acidithiobacillus ferrooxidans. Из этих микробов удалось выделить лишь 29 и 28 металлопротеинов соответственно, из которых только половина содержала железо. Самое главное, что все железосодержащие металлопротеины этих двух микробов оказались обычными, широко распространенными металлопротеинами, которые и у многих других организмов тоже содержат железо.
Тогда исследователи высказали дерзкую гипотезу. Они предположили, что ситуация, наблюдаемая у ферроплазмы, является случайно сохранившимся отголоском древнейших этапов развития жизни. Жизнь могла зародиться в микрополостях кристаллов пирита, в условиях, очень близких к тем, в которых ныне обитает ферроплазма. Главными отличиями этих микрополостей являются кислая среда и изобилие растворенного железа, которое в других, менее экзотических местообитаниях обычно в большом дефиците.
Древнейшие формы жизни поначалу активно использовали для осуществления необходимых химических реакций простые неорганические катализаторы, в первую очередь соединения железа и серы. Постепенно эти катализаторы замещались более эффективными органическими — то есть белками, и вполне естественно предположить, что первые белки включали в себя атомы железа как неотъемлемые структурные и функциональные компоненты. В дальнейшем, когда живые организмы стали осваивать другие местообитания, они сразу же столкнулись с резким дефицитом доступного железа, и отбор стал способствовать замене старых железосодержащих белков другими, не нуждающимися в железе для выполнения своих функций. В конце концов железо сохранилось только в тех белках, которые без него совсем уж никак обойтись не могут.
По мнению исследователей, обилие железосодержащих металлопротеинов у ферроплазмы объясняется тем, что предки этого микроба никогда не покидали кислых, богатых железом вод, и вся их эволюция протекала в условиях железного изобилия. Другие микроорганизмы, обитающие сегодня в похожих условиях, вероятно, попали туда вторично и на каких-то этапах своей эволюции сталкивались с дефицитом железа. Те немногочисленные белки ферроплазмы, в которых железа все-таки нет, возможно, достались ей от этих новых соседей в результате горизонтального (межвидового) обмена генами, что у микробов — обычное дело (см. главу «Наследуются ли приобретенные признаки»).
Впрочем, есть одно обстоятельство, заставляющее усомниться в столь глубокой древности ферроплазмы и ее металлопротеинов. Дело в том, что этот микроорганизм является аэробным, для окисления железа ему необходим кислород, тогда как древнейшие этапы эволюции жизни протекали в бескислородных условиях (см. главу «Планета микробов»).
(Источник: Manuel Ferrer, Olga V. Golyshina, Ana Beloqui, Peter N. Golyshin, Kenneth N.Timmis. The cellular machinery of Ferroplasma acidiphilum is iron-protein-dominated // Nature. 2007. V. 445. P. 91–94.)
—————
Как РНК решала энергетический вопрос. Чтобы два рибонуклеотида соединились вместе, образовав маленькую молекулу РНК, к одному из них должен быть присоединен дополнительный фосфат (или сразу два). Получившаяся молекула — рибонуклеотид с лишним фосфатом — обладает большим количеством энергии, которая при наличии подходящих катализаторов может быть использована для выполнения разных полезных «работ». В том числе для соединения двух рибонуклеотидов в одну молекулу — маленькую РНК. Рибонуклеотиды с дополнительными фосфатами первоначально использовались, скорее всего, только как «строительные кирпичики» при синтезе РНК. Кирпичики, надо сказать, очень удобные — ведь они включают в себя не только строительный материал, но еще и энергию, необходимую для выполнения строительных работ! Впоследствии они стали использоваться для тысяч других важных дел — везде, где для выполнения какой-то работы требуется энергия. Все живое и по сей день пользуется фосфорилированными рибонуклеотидами как универсальными поставщиками энергии при выполнении энергоемких задач. Самая известная из этих «энергетических» молекул — АТФ (аденозинтрифосфат). Это обычный рибонуклеотид, к которому присоединены два дополнительных фосфата. АТФ одновременно и источник энергии для множества энергоемких реакций, и один из кирпичиков для синтеза РНК. Так земная жизнь нашла универсальное решение сразу двух задач: запасания энергии в удобной форме и синтеза РНК — главных молекул жизни.
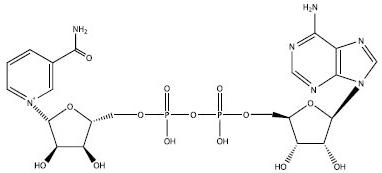
НАД (никотинамид-аденин-динуклеотид) — важнейший участник энергетического метаболизма клетки, используемый как универсальный переносчик протонов и электронов. Представляет собой два соединенных рибонуклеотида: обычный (аденозин) и «нестандартный» (никотинамид). Структура этого вещества — еще одно «напоминание» об эпохе РНК-мира.
—————
| <<< Назад Преджизнь |
Вперед >>> Оболочка |
