Книга: От атомов к древу. Введение в современную науку о жизни
Окислительно-восстановительные реакции
| <<< Назад Мембраны и транспорт |
Вперед >>> Источники углерода |
Окислительно-восстановительные реакции
В зависимости от того, откуда живые организмы берут энергию, их можно разделить всего на две главные категории: фототрофы, для которых источником энергии является свет, и хемотрофы, для которых источником энергии являются окислительно-восстановительные химические реакции. В отношении света нам вполне достаточно понимать, что это разновидность электромагнитных волн. А вот что такое окислительно-восстановительные реакции — придется пояснить, благо все необходимые для этого понятия мы из предыдущих глав уже знаем.
Итак, представим себе любое вещество, состоящее из молекул. Атомы в типичной молекуле соединены между собой ковалентными связями, каждая из которых образована парой электронов. Число ковалентных связей, которые может образовать данный атом, называется его валентностью (см. главу 1). Валентность водорода равна 1, кислорода 2, азота 3, углерода 4 и фосфора 5. В соединениях с ионными связями, где электроны целиком переходят от одного атома к другому, валентность каждого иона приравнивается к величине его заряда.
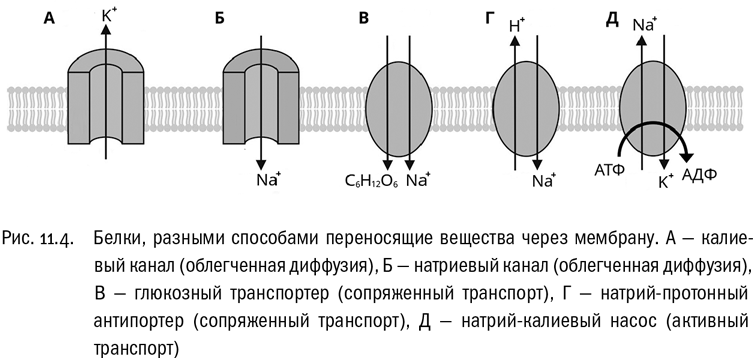
Ковалентные связи делятся на полярные и неполярные (см. главу 2). В неполярной ковалентной связи электроны, условно говоря, расположены точно посредине, а в полярной они смещены в сторону одного из атомов. Сила, с которой этот атом оттягивает на себя электроны, называется его электроотрицательностью. На самом-то деле правильнее говорить, что смещаются не целые электроны, а максимум плотности электронного облака. Но так или иначе из-за этого частичного смещения электронов атомы, участвующие в полярной ковалентной связи, приобретают маленькие (намного меньше единицы) электрические заряды. На одном атоме этот заряд положительный, на другом отрицательный. Например, на кислороде он обычно отрицательный, потому что электроотрицательность кислорода очень высока. Это означает, что он почти во всех своих соединениях оттягивает электроны на себя.
Еще древние философы знали, что человеческому уму гораздо удобнее работать с дискретными единицами, чем с непрерывными совокупностями. Вот поэтому химики и придумали чисто формальное, зато достаточно емкое понятие под названием «степень окисления». Степень окисления — это условный заряд данного атома, вычисленный исходя из предположения, что все его связи являются ионными (независимо от того, так ли это на самом деле). Неполярные ковалентные связи, в которых партнеры строго равноправны, в рамках этого определения игнорируются. А вот любую полярную ковалентную связь мы мысленно заменяем на ионную и воображаем, что каждый участвующий в ней электрон целиком захвачен каким-нибудь из атомов. Каким именно — зависит от электроотрицательности. Но в любом случае степень окисления может быть только целым числом. Например, молекула воды (H2O) состоит из одного атома кислорода (O) и двух атомов водорода (H), каждый из которых соединен с атомом кислорода одинарной ковалентной связью. Электроотрицательность кислорода больше, чем у водорода, поэтому электроны, образующие ковалентные связи, он оттягивает на себя. Это означает, что в молекуле воды атом кислорода имеет степень окисления –2, а каждый из атомов водорода +1. Молекула углекислого газа (CO2) состоит из атома углерода и двух атомов кислорода, соединенных с ним двойными ковалентными связями. В этой молекуле атом углерода имеет степень окисления +4, а каждый из атомов кислорода –2. Сумма степеней окисления всех атомов в любой частице равна ее полному электрическому заряду. Если эта частица — незаряженная молекула, то сумма степеней окисления всех атомов равна нулю. На примере углекислого газа и воды мы видим, что это действительно так.
Теперь посмотрим на вещи чуть шире. Некоторые химические реакции приводят к тому, что распределение электронной плотности у атомов существенно меняется. Попросту говоря, это означает, что около каких-то атомных ядер электронов становится меньше, а около каких-то больше. Понижение электронной плотности у данного атома называется окислением, а ее повышение — восстановлением. Говоря формально, окисление — это потеря электронов, а восстановление — приобретение электронов. Если атом, степень окисления которого до реакции была равна нулю, в результате реакции окислился, то его степень окисления становится положительной, а если восстановился, то отрицательной (поскольку заряд электрона равен –1). В реальных химических реакциях электроны могут только переходить от одних атомов к другим, поэтому процессы окисления и восстановления всегда идут одновременно. Вот те реакции, в которых они идут, и называются окислительно-восстановительными. Особо подчеркнем, что к этой категории относятся не все химические реакции, а только некоторые.
Например, уже знакомая нам реакция взаимодействия водорода и кислорода с образованием воды является типично окислительно-восстановительной. Посмотрим еще раз на уравнение этой реакции:
H2 + ?O2 ? H2O.
В левой части этого уравнения степени окисления водорода и кислорода по определению равны нулю. В правой же части мы видим, что водород окислился, а кислород восстановился. Иначе говоря, произошло перераспределение электронной плотности: у водорода она уменьшилась, а у кислорода увеличилась. Эта реакция (как мы уже знаем) энергетически выгодна. И неудивительно, что есть бактерии, способные реально использовать ее как источник энергии, — они называются водородными бактериями.
Вот еще один пример окислительно-восстановительной реакции, используемой некоторыми живыми существами для получения энергии:
CO2 + 4H2 ? CH4 + 2H2O.
Здесь происходит превращение углекислого газа (CO2) в метан (CH4), в результате которого атом углерода восстанавливается. В подобных случаях часто говорят попросту: углекислый газ восстанавливается до метана. Агентом-восстановителем в данном случае служит водород, который сам при этом окисляется. (Водород вообще часто бывает восстановителем, а его отнятие, наоборот, во многих реакциях равносильно окислению.) И это дает энергию, которую можно запасти в виде АТФ. Восстановление углекислого газа до метана — реакция, на которой основана вся жизнь метанообразующих архей, для краткости называемых метаногенами. Это очень древние и широко распространенные микробы, живущие в самых разных средах — от болот и горячих источников до кишечника млекопитающих.
Окислительно-восстановительные реакции, которыми пользуются живые организмы как источниками энергии, довольно разнообразны. Например, дыхание — это тоже окислительно-восстановительная реакция. В ходе нее углерод не восстанавливается, как у метаногенов, а, наоборот, окисляется до состояния углекислого газа (CO2). Эта реакция исключительно энергетически выгодна, так что АТФ в ходе нее получается очень много.
Для некоторых живых существ источниками энергии могут служить и неорганические окислительно-восстановительные реакции, идущие без всякого участия углерода. Простой пример такой реакции — окисление сероводорода (H2S) до чистой серы (S), степень окисления которой при этом меняется с отрицательной на нулевую:
H2S + ?O2 ? H2O + S.
Микроорганизмы, владеющие этим способом получения энергии, называются серобактериями (в данном случае это именно бактерии, а не археи). Энергетический обмен бактерий вообще очень многообразен. Есть, например, бактерии, которые не окисляют, а восстанавливают серу. А есть и такие, которые используют для получения энергии неорганические реакции с участием других элементов, например железа или азота. Кроме того, многие бактерии умеют получать энергию сразу несколькими способами, переключаясь с одного на другой в зависимости от внешних условий. Например, зеленые серобактерии владеют одновременно и окислением сероводорода, и фотосинтезом, то есть могут получать энергию просто из света. Надо еще раз оговорить, что под энергией мы сейчас фактически подразумеваем АТФ. «Способ получения энергии» — это любой процесс, позволяющий его синтезировать.
Интересно, что есть некоторое количество бактерий, вообще не умеющих (или почти не умеющих) самостоятельно синтезировать АТФ. Это — внутриклеточные паразиты, которые ухитряются довольствоваться готовым АТФ, синтезируемым клеткой хозяина. Их часто называют «энергетическими паразитами». Весь их механизм получения энергии может сводиться к АТФ-транспортерам, встроенным во внешнюю мембрану. Судя по современным данным, такими транспортерами служат в основном белки-антипортеры, одновременно переправляющие ненужный АДФ наружу и полезный АТФ внутрь.
| <<< Назад Мембраны и транспорт |
Вперед >>> Источники углерода |
- Две валюты
- АТФ и полифосфат
- АТФ и прочие молекулы
- Протоны и энергия
- Великая протонная альтернатива
- Третий резерв
- Мембраны и транспорт
- Окислительно-восстановительные реакции
- Источники углерода
- Формы жизни
- Три закона биоэнергетики
- Загадка дыхания
- От глюкозы до пирувата
- Цикл лимонной кислоты
- Дыхательная цепь
- Зубчатые колеса
- Поэма начала
- 97. Окислительно-восстановительная двойственность.
- 95. Составление уравнений окислительно-восстановительных реакций.
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 94. Окислительно-восстановительные реакции.
- 2. Аллергические реакции. Особенности инфекционной аллергии
- Тип стрессорной реакции – А или Б – генетически детерминирован
- Результат выработки реакции избегания незнакомых людей
- Устойчивость к стрессорным ситуациям – это скорость угасания стрессорной реакции
- Скорость угасания реакции
- Эндокринные реакции после неконтролируемого стресса у представителей типа А и Б
- Метод выработки реакции избегания незнакомых людей и домашних животных
- 3.6. Изменчивость признаков у организмов: модификационная, мутационная, комбинативная. Виды мутаций и их причины. Значен...
