Книга: Общая химия
94. Окислительно-восстановительные реакции.
| <<< Назад 93. Окисленность элементов. |
Вперед >>> 95. Составление уравнений окислительно-восстановительных реакций. |
94. Окислительно-восстановительные реакции.
Все химические реакции можно разбить на две группы. В реакциях первой группы окисленность всех элементов, входящих в состав реагирующих веществ, остается неизменной, а в реакциях второй группы окисленность одного или нескольких элементов изменяется.
В качестве примера реакций первой группы можно привести реакцию нейтрализации:
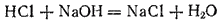
Примером реакции второй группы может служить взаимодействие металла с кислотой:
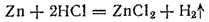
Если при реакции нейтрализации ни один элемент не изменяет степень своей окисленности, то во втором примере степень окисленности цинка изменяется от 0 до +2, а водорода — от +1 до 0.
Реакции, в результате которых изменяются степени окисленности элементов, называются окислительно-восстановительными.
- 257 -
Окислительно-восстановительные реакции имеют очень большое значение в биологических системах. Фотосинтез, дыхание, пищеварение — все это цепи окислительно-восстановительных реакций. В технике значение окислительно-восстановительных реакций также очень велико. Так, вся металлургическая промышленность основана на окислительно-восстановительных процессах В ходе которых металлы выделяются из природных соединений.
Простым примером окислительно-восстановительной реакции может служить реакция образования ионного соединения из простых веществ, например, взаимодействие натрия с хлором:
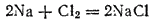
Эта реакция, как всякая гетерогенная реакция, протекает в несколько стадий. В ходе одной из них атомы натрия превращаются в положительно заряженные ионы; степень окисленности натрия изменяется от 0 до +1:
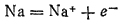
Такой процесс — отдача электронов, сопровождающаяся повышением степени окисленности элемента, - называется окислением.
Электроны, отдаваемые натрием, принимаются атомами хлора, которые превращаются при этом в отрицательно заряженные ионы; степень окисленности хлора изменяется от 0 до —1:
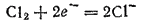
Присоединение электронов, сопровождающееся понижением степени окисленности элемента, называется восстановлением.
Таким образом, в рассматриваемой реакции натрий окисляется, а хлор восстанавливается.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, окислителем, Следовательно, в данном примере натрий — восстановитель, а хлор — окислитель.
Из уравнений процессов восстановления и окисления видно, что одна молекула хлора, восстанавливаясь, присоединяет два электрона, а окисление одного атома натрия сопровождается отдачей одного электрона. Общее число электронов в системе при химических реакциях не изменяется: число электронов, отдаваемых молекулами (атомами, ионами) восстановителя, равно числу электронов, присоединяемых молекулами (атомами, ионами) окислителя. Поэтому одна молекула хлора может окислить два атома натрия.
| <<< Назад 93. Окисленность элементов. |
Вперед >>> 95. Составление уравнений окислительно-восстановительных реакций. |
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- 97. Окислительно-восстановительная двойственность.
- 95. Составление уравнений окислительно-восстановительных реакций.
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- Окислительно-восстановительные реакции
- 2. Аллергические реакции. Особенности инфекционной аллергии
- Тип стрессорной реакции – А или Б – генетически детерминирован
- Результат выработки реакции избегания незнакомых людей
- Устойчивость к стрессорным ситуациям – это скорость угасания стрессорной реакции
- Скорость угасания реакции
- Эндокринные реакции после неконтролируемого стресса у представителей типа А и Б
- Метод выработки реакции избегания незнакомых людей и домашних животных
- 3.6. Изменчивость признаков у организмов: модификационная, мутационная, комбинативная. Виды мутаций и их причины. Значен...
