Книга: Общая химия
43. Гибридизация атомных электронных орбиталей.
| <<< Назад 42. Направленность ковалентной связи. |
Вперед >>> 44. Многоцентровые связи. |
43. Гибридизация атомных электронных орбиталей.
Метод гибридизации атомных орбиталей исходит из предположения, что при образовании молекулы вместо исходных атомных s-, p- и d-электронных облаков образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии. Но более полное перекрывание валентных электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии. Если этот выигрыш энергии достаточен, чтобы с избытком скомпенсировать затраты энергии на деформацию исходных атомных электронных облаков, такая гибридизация приводит, в конечном счете, к уменьшению потенциальной энергии образующейся молекулы и, следовательно, к повышению ее устойчивости.
- 130 -
Рассмотрим в качестве примера гибридизации образование молекулы фторида бериллия BeF2. Каждый атом фтора, входящий в состав этой молекулы, обладает одним неспаренным электроном,
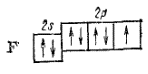
который и участвует в образовании ковалентной связи. Атом бериллия в невозбужденном состоянии (1s22s2) неспаренных электронов не имеет:
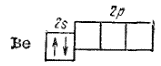
Поэтому для участия в образовании химических связей атом бериллия должен перейти в возбужденное состояние (1s22s12p1):
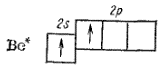
Образовавшийся возбужденный атом Be* обладает двумя неспаренными электронами: электронное облако одного из них соответствует состоянию 2s, другого — 2р. При перекрывании этих электронных облаков с р-электронными облаками двух атомов фтора могут образоваться ковалентные связи (рис. 38).
Однако, как уже было сказано, при затрате некоторой энергии вместо исходных s- и p-орбиталей атома бериллия могут образоваться две равноценные гибридные орбитали (sp-орбитали). Форма и расположение этих орбиталей показаны на рис. 39, из которого видно, что гибридные sp-орбитали вытянуты в противоположных направлениях.
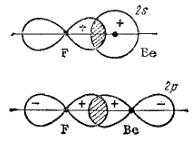
Рис 38. Схема перекрывания 2р-электронных облаков атомов фтора с 2s и 2р-электронными облаками атома бериллия (для каждой связи отдельно).
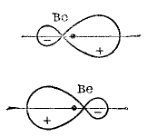
Рис. 39. Форма (схематическое изображение) и взаимное расположение гибридных sp-электронных облаков атома бериллия (для каждой гибридной орбитали отдельно).
- 131 -
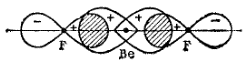
Рис. 40. Схема образования химических связей в молекуле BeF2.
В целях упрощения рисунка гибридные sp-электронные облака атома бериллия изображены не полностью.
Перекрывание гибридных sp-электронных облаков атома бериллия с p-электронными облаками атомов фтора изображено на рис. 40. Благодаря вытянутой форме гибридных орбиталей достигается более полное перекрывание взаимодействующих электронных облаков, а значит, образуются более прочные химические связи. Энергия, выделяющаяся при образовании этих связей, больше, чем суммарные затраты энергии на возбуждение атома бериллия и гибридизацию его атомных орбиталей. Поэтому процесс образования молекулы BeF2 энергетически выгоден.
Рассмотренный случай гибридизации одной s- и одной р-орбитали, приводящий к образованию двух sp-орбиталей, называется sp-гибридизацией. Как показывает рис. 39, sp-орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы. Действительно, молекула BeF2 линейна, а обе связи Be-F в этой молекуле во всех отношениях равноценны.
Возможны и другие случаи гибридизации атомных орбиталей, однако число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации. Так, при гибридизации одной s- и двух р-орбиталей ( sp2-гибридизация — читается «эс-пэ-два») образуются три равноценные sp2-орбитали. В этом случае гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углами 120° друг к другу (рис. 41). Очевидно, что этому типу гибридизации соответствует образование плоской треугольной молекулы.
Примером молекулы, в которой осуществляется sp2-гибридизация, может служить молекула фторида бора BF3. Здесь вместо исходных одной s- и двух р-орбиталей возбужденного атома бора
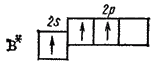
образуются три равноценные sp2-орбитали. Поэтому молекула BF3 построена в форме правильного треугольника, в центре которого расположен атом бора, а в вершинах—атомы фтора. Все три связи B-F в молекуле BF3 равноценны.
Если в гибридизации участвуют одна s- и три р-орбитали ( sp3 - гибридизация), то в результате образуются четыре гибридные sp3-орбитали, вытянутые в направлениях к вершинам тетраэдра, т. е. ориентированные под углами 109°28' друг к другу (рис. 42). Такая гибридизация осуществляется, например, в возбужденном атоме углерода при образовании молекулы метана CH4.
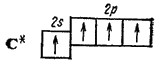
- 132 -
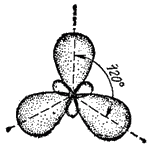
Рис. 41. Взаимное расположение гибридных sp2-электронных облаков.
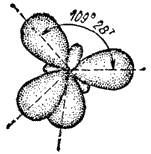
Рис. 42. Взаимное расположение гибридных sp3-электронных облаков.
Поэтому молекула метана имеет форму тетраэдра, причем все четыре связи C-H в этой молекуле равноценны.
Вернемся к рассмотрению структуры молекулы воды. При ее образовании происходит sp3-гибридизация атомных орбиталей кислорода. Именно поэтому валентный угол НОН в молекуле H2O (104.5°) близок не к 90°, а к тетраэдрическому углу (109,5°). Небольшое отличие этого угла от 109,5° можно понять, если принять во внимание неравноценность состояния электронных облаков, окружающих атом кислорода в молекуле воды. В самом деле, в молекуле метана (I)

все восемь электронов, занимающие в атоме углерода гибридные sp3-орбитали, участвуют в образовании ковалентных связей C-H. Это обусловливает симметричное распределение электронных облаков по отношению к ядру атома углерода. Между тем, в молекуле воды(II) только четыре из восьми электронов, занимающих гибридные sp3-орбитали атома кислорода, образуют связи O-H, а две электронные пары остаются неподеленными, т. е. принадлежат только атому кислорода. Это приводит к некоторой асимметрии в распределении электронных облаков, окружающих атом кислорода, и, как следствие, к отклонению угла между связями O-H от 109,5°.
При образовании молекулы аммиака также происходит sp3-гибридизация атомных орбиталей центрального атома (азота). Именно поэтому валентный угол HNH (107.3°) близок к тетраэдрическому. Небольшое отличие этого угла от 109,5° объясняется, как и в молекуле воды, асимметрией в распределении электронных облаков вокруг ядра атома азота: из четырех электронных пар три участвуют в образовании связей N — Н, а одна остается неподеленной.
Как показывают рис. 39, 41 и 42, гибридные электронные облака смещены относительно ядра атома.
- 133 -
Поэтому центр электрического заряда неподеленной электронной пары, находящейся на гибридной орбитали, не совпадает с положением атомного ядра, т. е. с центром имеющегося в атоме положительного заряда. Такое смещение заряда неподеленной электронной пары приводит к появлению дипольного момента, вносящего существенный вклад в суммарный дипольный момент молекулы. Из этого следует, что полярность молекулы зависит не только от полярности отдельных связей и их взаимного расположения (см. § 40), но и от наличия неподеленных электронных пар на гибридных орбиталях и от пространственного расположения этих орбиталей.
У элементов третьего и последующих периодов в образований гибридных электронных облаков могут участвовать и d-орбитали. Особенно важен случай sp3d2-гибридизации, когда в образовании гибридных орбиталей участвуют одна s-, три p- и две d-орбитали. В этом случае образуются шесть равноценных гибридных орбиталей, вытянутых в направлениях к вершинам октаэдра. Октаэдрическая структура молекулы SF6, ионов [SiF6]2-, [Fe(CN6)]3- и многих других объясняется sp3d2-гибридизацией атомных орбиталей центрального атома.
| <<< Назад 42. Направленность ковалентной связи. |
Вперед >>> 44. Многоцентровые связи. |
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- 961. Как избежать теплового загрязнения от атомных станций?
- Глава 6. «Гибридизация и этологическая изоляция у птиц»
- ГИБРИДИЗАЦИЯ РАСТЕНИЙ
- Устройство электронных оболочек
- 35. Строение атомных ядер. Изотопы.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 13. Определение атомных масс. Валентность.
- 45. Метод молекулярных орбиталей.
