Книга: Общая химия
47. Водородная связь.
| <<< Назад 46. Ионная связь. |
Вперед >>> Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ |
47. Водородная связь.
Еще в XIX веке было замечено, что соединения, в которых атом водорода непосредственно связан с атомами фтора, кислорода и азота, обладают рядом аномальных свойств. Это проявляется, например, в значениях температур плавления и кипения подобных соединений. Обычно в ряду однотипных соединений элементов данной подгруппы температуры плавления и кипения с увеличением атомной массы элемента возрастают. Это объясняется усилением взаимного притяжения молекул, что связано с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними (см.§ 48). Так, в ряду HCl-HBr-HI температуры плавления равны соответственно - 114,2, — 86,9 и - 50,8 ?. Аналогичная зависимость наблюдается и в ряду H2S-H2Se-H2Te. Однако, как показывают рис. 57 и 58, фтороводород и вода плавятся и кипят при аномально высоких температурах.
- 148 -
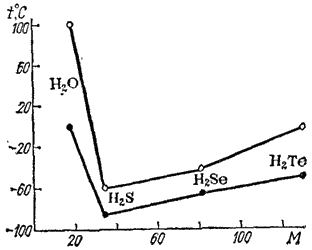
Рис. 57. Зависимость температуры плавления (?) и кипения (o) водородных соединений элементов главной подгруппы VI группы от молекулярной массы.
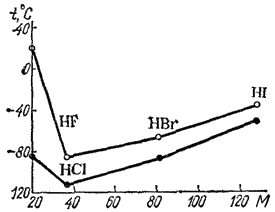
Рис. 58. Зависимость температуры плавления (?) и кипения (o) водородных соединений галогенов от молекулярной массы.
В настоящее время установлено, что эти и некоторые другие особенности указанных соединений объясняются способностью атома водорода, соединенного с атомом сильно электроотрицательного элемента, к образованию еще одной химической связи с другим подобным атомом. Эта связь называется водородной.
Возникновение водородной связи можно в первом приближении объяснить действием электростатических сил. Так, при образовании полярной ковалентной связи между атомом водорода и атомом фтора, который характеризуется высокой электроотрицательностью, электронное облако, первоначально принадлежавшее атому водорода, сильно смещается к атому фтора. В результате атом фтора приобретает значительный эффективный отрицательный заряд, а ядро атома водорода (протон) с «внешней» по отношению к атому фтора стороны почти лишается электронного облака. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы HF возникает электростатическое притяжение, что и приводит к образованию водородной связи. Это обусловлено тем, что, обладая ничтожно малыми размерами и, в отличие от других катионов, не имея внутренних электронных слоев, которые отталкиваются отрицательно заряженными атомами, ион водорода (протон) способен проникать в электронные оболочки других атомов.
Процесс образования водородной связи при взаимодействии двух молекул HF может быть представлен следующей схемой:
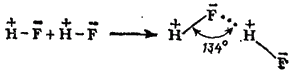
Здесь пунктиром обозначена водородная связь, а знаки "+" и "-" относятся к эффективным зарядам атомов.
Из сказанного ясно, что условием образования водородной связи является высокая злектроотрицательность атома, непосредственно связанного в молекуле с атомом водорода. Только при этом условии электронное облако атома водорода достаточно сильно смещается в сторону атома-партнера, а последний приобретает высокий эффективный отрицательный заряд. Именно поэтому водородная связь характерна для соединения самых электроотрицательных элементов: сильнее всего она проявляется у соединений фтора и кислорода, слабее — у соединений азота и еще слабее — у соединений хлора и серы.
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (150—400 кДж/моль). Она равна примерно 8 кДж/моль у соединений азота и достигает около 40 кДж/моль у соединений фтора. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, т. е. их объединение в димеры (удвоенные молекулы) или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но сохраняются и при переходе его в пар. Именно ассоциация молекул, затрудняющая отрыв их друг от друга, и служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Другие особенности этих веществ, обусловленные образованием водородных связей и ассоциацией молекул, будут рассмотрены ниже, при изучении отдельных соединений.
Водородная связь служит причиной некоторых важных особенностей воды — вещества, играющего огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты.
| <<< Назад 46. Ионная связь. |
Вперед >>> Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ |
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- 3. Водородная гипотеза
- ДНК и водородная бомба
- Сероводородная бомба
- 6.32. «ВОДОРОДНАЯ ЧУМА» ЖЕЛЕЗА
- 5.85. ВОДОРОДНАЯ ДИВЕРСИЯ
- Водородная связь
- 3. ВОДОРОД
- Атомные реакторы и электронные кристаллы
- Электролиз.
- Что такое Солнце?
- Гипотеза «дино сапиенса»
- Часть 1 «Многообещающие монстры» Происхождение эукариотической клетки
