Книга: Общая химия
116. Свойства и применение водорода.
| <<< Назад Водород в природе. Получение водорода. |
Вперед >>> 117. Пероксид водорода H2O2 |
116. Свойства и применение водорода.
Водород — бесцветный газ, не имеющий запаха. При температуре ниже -240.8°C (критическая температура водорода) он под давлением сжижается температура кипения жидкого водорода -252.8°C (при нормальном атмосферном давлении).
Если быстро испарять эту жидкость, то получается твердый водород в виде прозрачных кристаллов, плавящихся при -259.2°C.
Водород — самый легкий из всех газов, он в 14,5 раза легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г. В воде водород растворим очень мало, но в некоторых металлах, например в никеле, палладии, платине, растворяется в значительных количествах.
С растворимостью водорода в металлах связана его способность диффундировать через металлы. Кроме того, будучи самым легким газом, водород обладает наибольшей скоростью диффузии: его молекулы быстрее молекул всех других газов распространяются в среде другого вещества и проходят через разного рода перегородки. Особенно велика его способность к диффузии при повышенном давлении и высоких температурах. Поэтому работа с водородом в таких условиях сопряжена со значительными трудностями.
Диффузия водорода в сталь при высоких температурах может вызвать водородную коррозию стали. Этот совершенно особый вид коррозии состоит в том, что водород взаимодействует с имеющимся в стали углеродом, превращая его в углеводороды (обычно в метан), что приводит к резкому ухудшению свойств стали.
Химические свойства водорода в значительной степени определяются способностью его атомов отдавать единственный имеющийся у них электрон и превращаться в положительно заряженные ионы. При этом проявляется особенность атома водорода, отличающая его от атомов всех других элементов: отсутствие промежуточных электронов между валентным электроном и ядром. Ион водорода, образующийся в результате потери атомом водорода электрона, представляет собой протон, размер которого на несколько порядков меньше размера катионов всех других элементов. Поэтому поляризующее действие протона очень велико, вследствие чего водород не способен образовывать ионных соединений, в которых он выступал бы в качестве катиона. Его соединения даже с наиболее активными неметаллами, например с фтором, представляют собой вещества с полярной ковалентной связью.
Атом водорода способен не только отдавать, но и присоединять один электрон. При этом образуется отрицательно заряженный ион водорода с электронной оболочкой атома гелия. В виде таких ионов водород находится в соединениях с некоторыми активными металлами. Таким образом, водород имеет двойственную химическую природу, проявляя как окислительную, так и восстановительную способность. В большинстве реакций он выступает в качестве восстановителя, образуя соединения, в которых степень его окисленности равна +1.
Но в реакциях с активными металлами он выступает в качестве окислителя: степень окисленности его в соединениях с металлами равна —1.
Таким образом, отдавая один электрон, водород проявляет сходство с металлами первой группы периодической системы, а присоединяя электрон, — с неметаллами седьмой группы. Поэтому водород в периодической системе обычно помещают либо в первой группе и в то же время в скобках в седьмой, либо в седьмой группе и в скобках в первой.
Соединения водорода с металлами называются гидридами. Гидриды щелочных и щелочноземельных металлов представляют собой соли, т. е. химическая связь между металлом и водородом в них ионная. Это кристаллы белого цвета. Все они нестойки и при нагревании разлагаются на металл и водород. При действии на них воды протекает окислительно-восстановительная реакция, в которой гидрид-ион H- выступает в качестве восстановителя, а водород воды — в качестве окислителя:
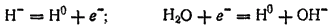
В результате реакции образуются водород и основание. Например, гидрид кальция реагирует с водой согласно уравнению:
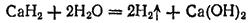
Эта реакция используется для определения следов влаги и для их удаления.
Кроме солеобразных известны металлообразные и полимерные гидриды. По характеру химической связи в металлообразных гидридах последние близки к металлам. Они обладают значительной электрической проводимостью и металлическим блеском, но очень хрупки. К ним относятся гидриды титана, ванадия, хрома. В полимерных гидридах (например, в гидридах цинка и алюминия) атомы металла связаны друг с другом водородными «мостиками», подобно тому, как это имеет место в молекулах бороводородов (стр. 612).
Если к струе водорода, выходящей из какого-нибудь узкого отверстия, поднести зажженную спичку, то водород загорается и горит несветящимся пламенем, образуя воду:
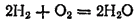
При поджигании смеси 2 объемов водорода с 1 объемом кислорода соединение газов происходит почти мгновенно во всей массе смеси и сопровождается сильным взрывом. Поэтому такую смесь называют гремучим газом. Стандартная энтальпия этой реакции в расчете на 1 моль образующейся жидкой воды равна -285.8 кДж, а в расчете на 1 моль водяного пара — 241.8 кДж. Таким образом, при горении водорода выделяется большое количество теплоты. Температура водородного пламени может достигать 2800°C. Водородно-кислородным пламенем пользуются для сварки и резки металлов, для плавления тугоплавких металлов.
При низких температурах водород с кислородом практически не взаимодействуют. Если смешать оба газа и оставить смесь, то и через несколько лет в ней нельзя обнаружить даже признаков воды. Если же смесь водорода с кислородом поместить в запаянный сосуд и держать в нем при 300°C, то уже через несколько дней образуется немного воды. При 500°C водород полностью соединяется с кислородом за несколько часов, а при нагревании смеси до 700°C происходит быстрый подъем температуры и реакция заканчивается практически мгновенно. Поэтому, чтобы вызвать взрыв смеси, нужно нагреть ее хотя бы в одном месте до 700°C.
Малая скорость взаимодействия водорода с кислородом при низких температурах обусловлена высокой энергией активации этой реакции. Молекулы водорода и кислорода очень прочны; любое столкновение между ними при комнатной температуре оказывается неэффективным. Лишь при повышенных температурах, когда кинетическая энергия сталкивающихся молекул делается большой, некоторые соударения молекул становятся эффективными и приводят к образованию активных центров.
Применение катализатора может сильно увеличить скорость взаимодействия водорода с кислородом. Внесем, например, кусочек платинированного (т. е. покрытого мелко раздробленной платиной) асбеста в смесь водорода с кислородом. Взаимодействие между газами настолько ускоряется, что через короткое время происходит взрыв.
Напомним, что реакция между водородом и кислородом является цепной и протекает по разветвленному механизму (см. § 62).
При высокой температуре водород может отнимать кислород от многих соединений, в том числе от большинства оксидов металлов. Например, если пропускать водород над накаленным оксидом меди, то происходит восстановление меди:
CuO + H2 = Cu + H2O
Поэтому водород применяют в металлургии для восстановления некоторых цветных металлов из их оксидов. Главное применение водород находит в химической промышленности для синтеза хлороводорода (см. § 121), для синтеза аммиака (см. § 138), идущего в свою очередь на производство азотной кислоты и азотных удобрений, для получения метилового спирта (см. § 169) и других органических соединений. Он используется для гидрогенизации жиров (см.§ 173), угля и нефти. При гидрогенизации угля и нефти бедные водородом низкосортные виды топлива превращаются в высококачественные.
- 335 -
Водород используют для охлаждения мощных генераторов электрического тока, а его изотопы находят применение в атомной энергетике (см. стр. 108).
Атомарный водород. При высокой температуре молекулы водорода диссоциируют на атомы:
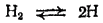
Осуществить эту реакцию можно, например, раскаляя током вольфрамовую проволочку в атмосфере сильно разреженного водорода. Реакция обратима, и чем выше температура, тем сильнее равновесие сдвинуто вправо. При 2000°C степень диссоциации (т. е. доля молекул, подвергшихся диссоциации) составляет только 0,1%, при 3000°C - 9%, при 4000°C - 62,5%, при 5000°C - 94,7% (все величины относятся к случаю, когда давление в системе равно нормальному атмосферному давлению).
Атомарный водород получается также при действии тихого электрического разряда - на молекулярный водород, находящийся под давлением около 70 Па. Образующиеся при этих условиях атомы водорода не сразу соединяются в молекулы, что дает возможность изучить их свойства.
При разложении водорода на атомы поглощается большое количество теплоты:

Отсюда понятно, что атомы водорода должны быть гораздо активнее его молекул. Чтобы молекулярный водород вступил в какую-либо реакцию, молекулы должны сперва распасться на атомы, для чего необходимо затратить большое количество энергии. При реакциях же атомарного водорода такой затраты энергии не требуется.
Действительно, атомарный водород уже при комнатной температуре восстанавливает многие оксиды металлов, непосредственно соединяется с серой, азотом и фосфором; с кислородом, он образует пероксид водорода.
| <<< Назад Водород в природе. Получение водорода. |
Вперед >>> 117. Пероксид водорода H2O2 |
- 117. Пероксид водорода H2O2
- Водород в природе. Получение водорода.
- КРЕМНИЙ (SILICIUM) 178. Кремний в природе. Получение и свойства кремния.
- Применение бамбука
- Глава 6. Самое главное применение
- § 53 Соли и их применение
- Применение солей.
- Применение рентгеновских лучей
- Применение коронного разряда
- Практическое применение фагов
- ЕСТЕСТВЕННАЯ СИСТЕМА ЭЛЕМЕНТОВ И ПРИМЕНЕНИЕ ЕЕ К УКАЗАНИЮ СВОЙСТВ НЕОТКРЫТЫХ ЭЛЕМЕНТОВ. Д. И. Менделеев
- 4.11. ЛЕГЧЕ ВОДОРОДА?
