Книга: Общая химия
150. Сурьма (Stibium).
| <<< Назад 149. Мышьяк (Arsenicum). |
Вперед >>> 151. Висмут (Bismuthum). |
150. Сурьма (Stibium).
Сурьма обычно встречается в природе в соединении с серой — в виде сурьмяного блеска, или антимонита, Sb2S3. Несмотря на то, что содержание сурьмы в земной коре сравнительно невелико [0,00005% (масс.)], сурьма была известна еще в глубокой древности. Это объясняется распространенностью в природе сурьмяного блеска и легкостью получения из него сурьмы. При прокаливании на воздухе сурьмяный блеск превращается в оксид сурьмы Sb2S3, из которого сурьма получается путем восстановления углем.
В свободном состоянии сурьма образует серебристо-белые кристаллы, обладающие металлическим блеском и имеющие плотность 6,68 г/см3. Напоминая по внешнему виду металл, кристаллическая сурьма отличается хрупкостью и значительно хуже проводит теплоту и электрический ток, чем обычные металлы. Кроме кристаллической сурьмы, известны и другие ее аллотропические видоизменения.
Сурьму вводят в некоторые сплавы для придания им твердости. Сплав, состоящий из сурьмы, свинца и небольшого количества олова, называется типографским металлом или гартом и служит для изготовления типографского шрифта. Из сплава сурьмы со свинцом (от 5 до 15% Sb) изготовляют пластины свинцовых аккумуляторов, листы и трубы для химической промышленности. Кроме того, сурьму применяют как добавку к германию для придания ему определенных полупроводниковых свойств.
В царской России, несмотря на наличие сырьевой базы, сурьму не получали. Выплавка сурьмы из отечественных руд началась лишь после Октябрьской революции.
В своих соединениях сурьма обнаруживает большое сходство с мышьяком, но отличается от него более сильно выраженными металлическими свойствами.
Стибин, или гидрид сурьмы, SbH3 — ядовитый газ, образующийся в тех же условиях, что и арсин. При нагревании он еще легче, чем арсин, разлагается на сурьму и водород.
Сурьма образует соединения с металлами — антимониды, - которые можно рассматривать как продукты замещения водорода в стибине атомами металла. В этих соединениях сурьма, как и в SbH3, имеет степень окисленности —3. Некоторые из антимонидов, в частности AlSb, GaSb и InSb, обладают полупроводниковыми свойствами и используются в электронной промышленности.
Оксид сурьмы(III), или сурьмянистый ангидрид, Sb2O3 типичный амфотерный оксид с некоторым преобладанием основных свойств.
- 415 -
В сильных кислотах, например серной и соляной, оксид сурьмы (III) растворяется с образованием солей сурьмы (III):
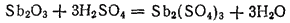
Оксид сурьмы (III) растворяется также в щелочах с образованием солей сурьмянистой H3SbO3 или метасурьмянистой HSbO2 кислоты. Например:
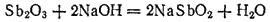
Сурьмянистая кислота, или гидроксид сурьмы (III), Sb(OH)3 получается в виде белого осадка при действии щелочей на соли сурьмы (III):
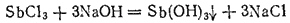
Осадок легко растворяется как в избытке щелочи, так и в кислотах.
Соли сурьмы (III), как соли слабого основания, в водном растворе подвергаются гидролизу с образованием основных солей:
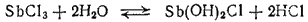
Образующаяся основная соль Sb(OH)2Cl неустойчива и разлагается с отщеплением молекулы воды:
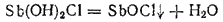
В соли SbOCl группа SbO играет роль одновалентного металла; эту группу называют антимонилом. Полученная основная соль называется или хлоридом антимонила, или хлороксидом сурьмы.
Оксид сурьмы(V), или сурьмяный ангидрид, Sb2O5 обладает главным образом кислотными свойствами; ему соответствует сурьмяная кислота, существующая в водном растворе в нескольких формах. Соли сурьмяной кислоты называются антимонатами.
Сульфиды сурьмы Sb2S2 и Sb2S5 по свойствам аналогичны сульфидам мышьяка. Они представляют собой вещества оранжево-красного цвета, растворяющиеся в сульфидах щелочных металлов и аммония с образованием тиосолей. Сульфиды сурьмы используются при производстве спичек и в резиновой промышленности.
| <<< Назад 149. Мышьяк (Arsenicum). |
Вперед >>> 151. Висмут (Bismuthum). |
- АЗОТ (NITROGENIUM)* 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- ФОСФОР (PHOSPHORUS) 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- 143. Промышленное получение азотной кислоты.
- 151. Висмут (Bismuthum).
- 149. Мышьяк (Arsenicum).
- 144. Круговорот азота в природе.
- 141. Азотистая кислота.
- 146. Соединения фосфора с водородом и галогенами.
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- 134. Соединения серы с галогенами.
- 139. Гидразин. Гидроксиламин. Азидоводород.
