Книга: Общая химия
86. Сильные электролиты.
| <<< Назад 85. Константа диссоциации. |
Вперед >>> 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. |
86. Сильные электролиты.
В водных растворах сильные электролиты обычно полностью диссоциированы. Поэтому число ионов в них больше, чем в растворах слабых электролитов той же концентрации. И если в растворах слабых электролитов концентрация ионов мала, расстояния между ними велики и взаимодействие ионов друг с другом незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнительно мало. Например, в насыщенном растворе хлорида натрия среднее расстояние между ионами всего только в 2 раза больше, чем в кристаллах NaCl. При этом силы межионного притяжения и отталкивания довольно велики. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы».
В отсутствие внешнего электрического поля ионная атмосфера симметрична и силы, действующие на центральный ион, взаимно уравновешиваются. Если же приложить к раствору постоянное электрическое поле, то разноименно заряженные ионы будут перемещаться в противоположных направлениях. При этом каждый ион стремится двигаться в одну сторону, а окружающая его ионная атмосфера — в противоположную, вследствие чего направленное перемещение иона замедляется, а следовательно, уменьшается число ионов, проходящих через раствор в единицу времени, т. е. сила тока. Чем больше концентрация раствора, тем сильнее проявляется тормозящее действие ионной атмосферы на электрическую проводимость раствора. Значения степени диссоциации хлорида калия, вычисленные при 18°C по электрической проводимости его растворов, показывают, что с ростом концентрации ? падает:
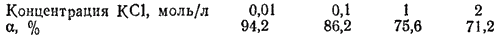
Однако падение степени диссоциации объясняется не образованием молекул, а увеличением тормозящего действия ионной атмосферы. В связи с этим, определяемое по электрической проводимости (или другими методами) значение степени диссоциации сильных электролитов называется кажущейся степенью диссоциации.
Аналогично силы межионного притяжения и отталкивания влияют и на величину осмотического давления, которая, несмотря на полную диссоциацию, все же меньше, чем следовало бы ожидать при удвоенном, утроенном и большем числе частиц.
- 233 -
Следовательно, все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита.
Для оценки состояния ионов в растворе пользуются величиной, называемой активностью.
Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях. Активность иона а равна его концентрации С, умноженной на коэффициент активности f:
a = fC
Коэффициенты активности различных ионов различны. Кроме того, они изменяются при изменении условии, в частности, при изменении концентрации раствора. В концентрированных растворах коэффициент активности обычно меньше единицы, а с разбавлением раствора он приближается к единице. Значение f, меньшее единицы, указывает на взаимодействие между ионами, приводящее к их взаимному связыванию. Если же коэффициент активности близок к единице, то это свидетельствует о слабом межионном взаимодействии. Действительно, в очень разбавленных растворах средние расстояния между ионами настолько велики, что действие межиониых сил почти не проявляется.
В разбавленных растворах природа ионов мало влияет на значения их коэффициентов активности. Приближенно можно считать, что коэффициент активности данного иона зависит только от его заряда и от ионной силы раствора I, под которой понимают полусумму произведений концентраций всех находящихся в растворе ионов на квадрат их заряда:
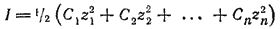
Вычислим, например, ионную силу раствора, содержащего 0,1 моль/л хлорида натрия и 0,1 моль/л хлорида бария. Здесь концентрация ионов Na+(C1) равна 0,1 моль/л, z1 = 1; концентрация ионов Ba2+(C2) равна 0,1 моль/л, z2 = 2; общая концентрация хлорид-ионов (C3) составляет 0,1+0,1·2=0,3 моль/л, z3 = -1. Таким образом
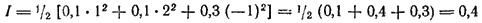
Таблица 13. Коэффициенты активности ионов f при различных ионных силах раствора
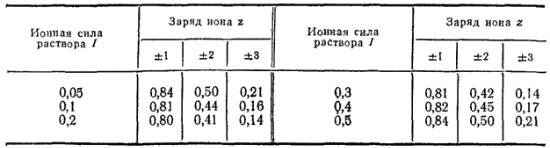
В табл. 13 приведены значения коэффициентов активности для ионов разного заряда при различных ионных силах раствора.
- 234 -
Пользуясь данными этой таблицы, нетрудно, например, установить, что в упомянутом выше растворе коэффициенты активности однозарядных ионов Na+ и Cl- одинаковы и равны 0,82, а коэффициент активности двухзарядного иона Ba2+ равен 0,45.
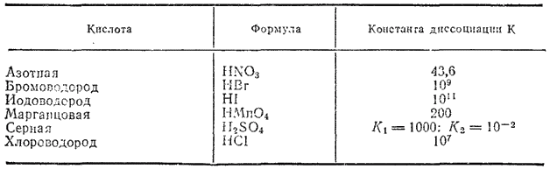
Если пользоваться значениями активности, то законы химического равновесия можно применять и к сильным электролитам. В частности, при этом можно получить значения констант диссоциации сильных кислот. В выражении константы диссоциации вместо концентраций ионов и недиссоциированных молекул будут стоять их активности. Несмотря на некоторую формальность такого рода констант, они полезны, так как дают возможность сравнивать друг с другом свойства сильных кислот. В табл. 14 приведены константы диссоциации некоторых сильных кислот, выраженные через активности.
Таблица 14. Константы диссоциации некоторых сильных кислот в водных растворах при 25°C
| <<< Назад 85. Константа диссоциации. |
Вперед >>> 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. |
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 83. Процесс диссоциации.
- 85. Константа диссоциации.
- 89. Произведение растворимости.
- 82. Теория электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 84. Степень диссоциации. Сила электролитов.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- Сноски из книги
- Нотротерий
- Далеко ли до луны
- Читателям, еще не полюбившим ботанику
