Книга: Общая химия
83. Процесс диссоциации.
| <<< Назад 82. Теория электролитической диссоциации. |
Вперед >>> 84. Степень диссоциации. Сила электролитов. |
83. Процесс диссоциации.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны при этом два случая.
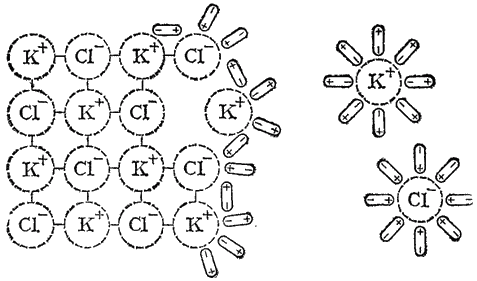
Рис. 80. Схема растворения соли.
Один из них — это диссоциация растворяющихся солей, т. е. кристаллов с ионной структурой, второй — диссоциация при растворении кислот, т. е. веществ, состоящих из полярных молекул.
Когда кристалл соли, например, хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (нон-диполькое взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными (рис. 80). Но, если ионы притягивают к себе молекулы воды, то и молекулы воды с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
Иначе протекает диссоциация полярных молекул (рис. 81). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов— поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит в конечном счете к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются.
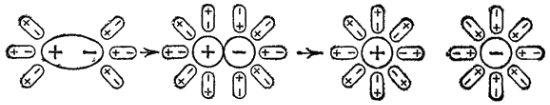
Рис. 81. Схема диссоциации полярных молекул в растворе.
- 228 -
При этом ион водорода H+ (т. е. протон) оказывается прочно связанным с молекулой воды в ион гидроксония H3O+. Так, при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:
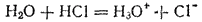
В результате этого процесса молекула HCl расщепляется таким образом, что общая пара электронов остается у атома хлора, который превращается в ион Cl-, а протон, внедряясь в электронную оболочку атома кислорода в молекуле воды, образует ион гидросония H3O+.
Подобного же рода процессы происходят и при растворении в воде других кислот, например, азотной:
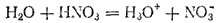
Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. Иначе говоря, в результате диссоциации образуются не свободные ноны, а соединения ионов с молекулами растворителя. В общем случае любого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов, тем более что число молекул растворителя, связанных с ионами, изменяется в зависимости от концентрации раствора и других условий.
Диссоциации веществ как ионного, так и молекулярного строения способствует полярность молекул растворителя. Поэтому не только вода, но и другие жидкости, состоящие из полярных молекул (муравьиная кислота, этиловый спирт, аммиак и другие), также являются ионизирующими растворителями: соли, кислоты и основания, растворенные в этих жидкостях, диссоциируют на ионы.
| <<< Назад 82. Теория электролитической диссоциации. |
Вперед >>> 84. Степень диссоциации. Сила электролитов. |
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- 85. Константа диссоциации.
- 82. Теория электролитической диссоциации.
- 25. Аутоиммунные процессы
- 3. Аутоиммунные процессы
- § 20. Внешние процессы, преображающие поверхность Земли
- Взаимосвязь между эволюционными и фенотипическими параметрами, универсалии эволюции генов, белков и геномов и физическая...
- Краткий обзор и перспектива: о природе эволюционного процесса
- Структура и эволюция сетей: всеобщность степенного закона и стоящие за ним фундаментальные процессы
- Горизонтальный перенос генов – определяющий процесс в эволюции прокариот
- Воспроизводимость эволюции: детерминизм и стохастика эволюционного процесса
- Плюрализм паттернов и процессов эволюции: смена концепций отбора, вариации и древа жизни
- Жгутик после дуврского процесса
