Книга: Общая химия
89. Произведение растворимости.
| <<< Назад 88. Ионно-молекулярные уравнения. |
Вперед >>> 90. Диссоциация воды. Водородный показатель. |
89. Произведение растворимости.
Мы знаем (§ 73), что при растворении твердого тела в воде растворение прекращается, когда получается насыщенный раствор, т. е. когда между растворяемым веществом и находящимися в растворе молекулами того же вещества установится равновесие. При растворении электролита, например соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор нонами. Например, в насыщенном растворе сульфата кальция устанавливается равновесие
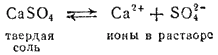
Константа равновесия для этого процесса выразится уравнением:
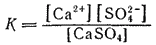
Знаменатель дроби — концентрация твердой соли — представляет собою постоянную величину, которую можно ввести в константу. Тогда, обозначая K[CaSO4]=K', получим:
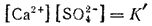
Таким образом, в насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Эта величина количественно характеризует способность электролита растворяться; ее называют произведением растворимости электролита и обозначают буквами ПР.
Заменив величину K' на ПРCaSO4, получим:
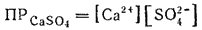
Численное значение произведения растворимости электролита нетрудно найти, зная его растворимость. Например, растворимость сульфата кальция при 20°C равна 1.5·10-2 моль/л. Это значит, что в насыщенном растворе концентрация каждого из ионов Ca2+ и SO42- равна 1.5·10-2 моль/л.
- 242 -
Следовательно, произведение растворимости этой соли
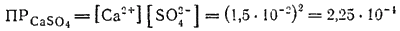
Приведенный расчет, сделанный на основе классической теории электролитической диссоциации, не вполне точен, так как здесь не учтено влияние на растворимость электролита электростатических сил, действующих между ионами. Если учесть это влияние, т. е. если вместо концентраций Ca2+ и SO42- перемножать их активности в насыщенном растворе CaSO4, то величина произведения растворимости несколько уменьшится; уточненное значение ПРCaSO4 равно 1.3·10-4.
В случае очень мало растворимых электролитов слияние указанных сил можно не принимать во внимание.
В тех случаях, когда электролит содержит два или несколько одинаковых ионов, концентрации этих ионов при вычислении произведения растворимости должны быть возведены в соответствующие степени. Например:
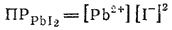
Знание произведения растворимости позволяет решать вопросы, связанные с образованием или растворением осадков при химических реакциях, что особенно важно для аналитической химии. Надо, однако, иметь в виду, что произведение растворимости, вычисленное без учета коэффициентов активности, является постоянной величиной только для малорастворимых электролитов и при условии, что концентрации других находящихся в растворе ионов невелики. Это объясняется тем, что коэффициенты активности близки к единице только в очень разбавленных растворах (см. стр. 233), Для хорошо растворимых электролитов значение произведения концентраций ионов в насыщенном растворе может сильно изменяться в присутствии других веществ. Это происходит вследствие изменения коэффициентов активности ионов. Поэтому расчеты, производимые по произведению растворимости без учета коэффициентов активности, приводят в этих случаях к неверным результатам.
Таблица 16. Произведения растворимости некоторых веществ при 25°C

В табл. 16 приведены величины произведения растворимости некоторых малорастворимых соединений в воде.
- 243 -
| <<< Назад 88. Ионно-молекулярные уравнения. |
Вперед >>> 90. Диссоциация воды. Водородный показатель. |
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
