Книга: Общая химия
90. Диссоциация воды. Водородный показатель.
| <<< Назад 89. Произведение растворимости. |
Вперед >>> 91. Смещение ионных равновесий. |
90. Диссоциация воды. Водородный показатель.
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электрической проводимостью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы:
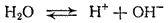
По величине электрической проводимости чистой воды можно вычислить концентрацию ионов водорода и гидроксид-ионов в воде. При 25°C она равна 10-7 моль/л.
Напишем выражение для константы диссоциации воды:
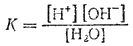
Перепишем это уравнение следующим образом:
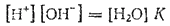
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул H2O в воде практически равна общей концентрации воды, т. е. 55,55 моль/л (1 л. содержит 1000 г. воды, т. е. 1000:18.02=55.55 моль). В разбавленных водных растворах концентрацию воды можно считать такой же. Поэтому, заменив в последнем уравнении произведение [H2O] новой константой KH2O будем иметь:
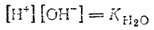
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентрата ионов водорода и гидроксид-ионов есть величина постоянная, Эта постоянная величина называется ионным произведением воды. Численное значение ее нетрудно получить, подставив в последнее уравнение концентрации ионов водорода и гидроксид-ионов. В чистой воде при 25°C [H+]=[OH-]=1·10-7 моль/л. Поэтому для указанной температуры:
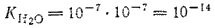
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. При 25°C, как уже сказано, в нейтральных растворах концентрация как ионов водорода, так и гидроксид-ионов равна 10-7 моль/л. В кислых растворах больше концентрация ионов водорода, в щелочных — концентрация гидроксид-ионов. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид-ионов остается постоянным.
- 244 -
Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода повысилась до 10-3 моль/л, то концентрация гидроксид-ионов понизится так, что произведение [H+][OH-] останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет:
[OH-]=10-14/10-3=10-11 моль/л
Наоборот, если добавить к воде щелочи и тем повысить концентрацию гидроксид-ионов, например, до 10-5 моль/л, то концентрация ионов водорода составит:
[H+]=10-14/10-5=10-9 моль/л
Эти примеры показывают, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
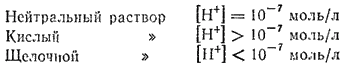
Кислотность или щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают ее десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается через pH:
pH = - lg[H+]
Например, если [H+]=10-5 моль/л, то pH=5 ; если [H+]=10-9 моль/л, то pH=9 и т. д. Отсюда ясно, что в нейтральном растворе ([H+]=10-7 моль/л) pH=7. В кислых растворах pH<7 и тем меньше, чем кислее раствор. Наоборот, в щелочных растворах pH>7 и тем больше, чем больше щелочность раствора.
Для измерения pH существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространенные индикаторы — метиловый оранжевый, метиловый красный, фенолфталеин. В табл. 17 дана характеристика некоторых индикаторов.
Для многих процессов значение pH играет важную роль. Так, pH крови человека и животных имеет строго постоянное значение. Растения могут нормально произрастать лишь при значениях pH почвенного раствора, лежащих в определенном интервале, характерном для данного вида растения. Свойства природных вод, в частности их коррозионная активность, сильно зависят от их pH.
- 245 -
Таблица 17. Важнейшие индикаторы

| <<< Назад 89. Произведение растворимости. |
Вперед >>> 91. Смещение ионных равновесий. |
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- Диссоциация и трансформация
- Образцово-показательный вид животных
- Юпитер. Жестокий, злой и водородный
- Обезьяний процесс: показательный суд над эволюцией
- Глава II Снижение "запаса прочности" — показатель старения организма
- 207. Диссоциация комплексных соединений в растворах.
- Показательные выступления партнёров
