Книга: От атомов к древу. Введение в современную науку о жизни
Водородная связь
| <<< Назад 2. Вода |
Вперед >>> Любовь и ненависть воды |
Водородная связь
Начнем вот с чего. В общей химии часто встречается понятие «электроотрицательность», введенное когда-то Лайнусом Полингом. Электроотрицательность — это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент — фтор (F), а сразу за ним на шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко. Запомним этот факт, он нам пригодится.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующая ее пара электронов никуда не смещается. Грубо говоря, эти электроны располагаются между атомами точно посредине. Такая ковалентная связь называется неполярной. Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H?H или углерод-углеродная связь C–C).
Если же ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого электроотрицательность выше. Такая связь называется полярной (см. рис. 2.1, 2.2А). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную — это случится, если один атом полностью «отберет» общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные — очень часто. Например, это широко распространенные в органических веществах связи C?O и H?O (см. главу 1).
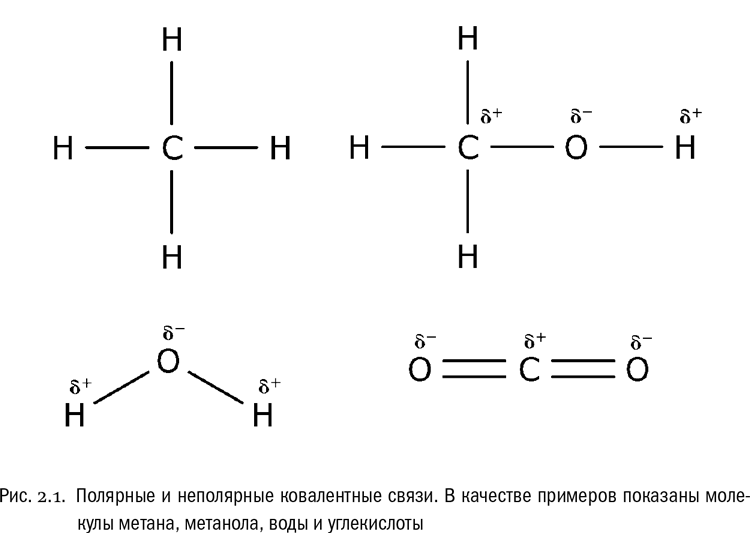
Связь между водородом и кислородом в молекуле воды — это типичная ковалентная полярная связь. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на атоме кислорода образуется маленький отрицательный заряд, а на атомах водорода — маленькие положительные заряды. На графических формулах эти маленькие заряды, величина которых значительно меньше единицы, принято обозначать буквой ? («дельта») с добавлением соответствующего знака. Как мы теперь знаем, связи кислорода с водородом или углеродом вообще всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде (см. рис. 2.1, 2.2Б).

А вот связь между углеродом и водородом (C?H) считается неполярной, хоть атомы и разные. И это тоже очень важно. Между атомами углерода и водорода разница в электроотрицательности настолько мала, что смещение электронов там незаметно. Например, молекулы углеводородов, состоящие только из атомов C и H, в силу этого полностью неполярны, никаких частичных зарядов, которые хоть на что-то влияли бы, в них нет.
Теперь вспомним, что положительные и отрицательные электрические заряды согласно закону Кулона притягиваются друг к другу. Например, частично отрицательный атом кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул воды. В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, — они называются водородными (см. рис. 2.2В). Это очень слабые связи, в жидкой воде они легко образуются и так же легко рвутся при движениях молекул. Но, несмотря на то что водородные связи гораздо слабее ковалентных, они дают сильный эффект, если их много. А в воде их очень много. Например, именно из-за колоссального количества водородных связей у воды исключительно высокая теплоемкость — ее трудно нагреть и трудно остудить. Большинство особенностей воды так или иначе связано с тем, что ее молекулы очень хорошо образуют водородные связи.
«Водородная связь чем-то напоминает любовь втроем», — писал в своем известном университетском учебнике американский биохимик Люберт Страйер[18]. Он имел в виду, что в водородной связи атом водорода связан сразу с двумя атомами кислорода: с одним ковалентно (и прочно), а с другим электростатически (и слабо). Чтобы образовать водородную связь, атом водорода обязательно должен уже состоять в ковалентной связи с другим атомом, причем значительно отличающимся от него по электроотрицательности.
Водородные связи важны не только с точки зрения свойств воды. Они много где встречаются. Например, в главе 9 мы увидим, что без водородных связей невозможно представить себе структуру молекулы ДНК, от которой зависит хранение наследственной информации.
| <<< Назад 2. Вода |
Вперед >>> Любовь и ненависть воды |
- 3. Водородная гипотеза
- ДНК и водородная бомба
- Сероводородная бомба
- 6.32. «ВОДОРОДНАЯ ЧУМА» ЖЕЛЕЗА
- 5.85. ВОДОРОДНАЯ ДИВЕРСИЯ
- 47. Водородная связь.
- 3. ВОДОРОД
- Атомные реакторы и электронные кристаллы
- Электролиз.
- Что такое Солнце?
- Гипотеза «дино сапиенса»
- Часть 1 «Многообещающие монстры» Происхождение эукариотической клетки
