Книга: Общая химия
31. Много электронные атомы.
| <<< Назад 30. Магнитное и спиновое квантовые числа. |
Вперед >>> 32. Принцип Паули. Электронная структура атомов и периодическая система элементов. |
31. Много электронные атомы.
В атоме водорода электрон находится в силовом поле, которое создается только ядром. В много электронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако.
- 82 -
Точное решение уравнения Шредингера для таких сложных систем связано с большими затруднениями и, как правило, недостижимо. Поэтому состояние электронов в сложных атомах и в молекулах определяют путем приближенного решения уравнения Шредингера.
Общим для всех приближенных методов решения этого уравнения является так называемое одноэлектронное приближение, т.е. предположение, что волновая функция много электронной системы может быть представлена в виде суммы волновых функций отдельных электронов. Тогда уравнение Шредингера может решаться отдельно для каждого находящегося в атоме электрона, состояние которого, как и в атоме водорода, будет определятся значениями квантовых чисел n, l, m и s. Однако и при этом упрощении решение уравнения Шредингера для много электронных атомов и молекул представляет весьма сложную задачу и требует большого объема трудоемких вычислений. В последние годы подобные вычисления выполняются, как правило, с помощью быстродействующих электронных вычислительных машин, что позволило произвести необходимые расчеты для атомов всех элементов и для многих молекул.
Исследование спектров многоэлектронных атомов показало, что здесь энергетическое состояние электронов зависит не только от главного квантового числа n, но и от орбитального квантового числа l. Это связано с тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов, расположенных между данным электроном и ядром. Внутренние электронные слои как бы образуют своеобразный экран, ослабляющий притяжение электрона к ядру, или, как принято говорить, экранируют внешний электрон от ядреного заряда. При этом для электронов, различающихся значением орбитального квантового числа l, экранирование оказывается неодинаковым.
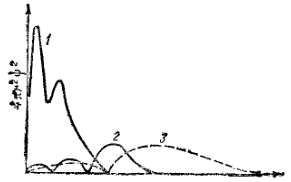
Рис. 21. График радиального распределения вероятности в атоме натрия.
1 — для десяти электронов K и L-слоев; 2 — для 3s-электрона; 3 — для 3p-электрона.
Так, в атоме натрия (порядковый номер Z = 11)ближайшие к ядру K- или L-слои заняты десятью электронами; одиннадцатый электрон принадлежит к M-слою (n=3). На рис. 21 кривая 1 изображает радиальное распределение вероятности для суммарного электронного облака десяти «внутренних» электронов атома натрия: ближайший к ядру максимум электронной плотности соответствует K-слою, второй максимум — L-слою. Преобладающая часть внешнего электронного облака атома натрия расположена вне области, занятой внутренними электронами, и потому сильно экранируется.
- 83 -
Однако часть этого электронного облака проникает в пространство, занятое внутренними электронами, и потому экранируется слабее.
Какое же из возможных состояний внешнего электрона атома натрия — 3s, 3p или 3d — отвечает более слабому экранированию и, следовательно, более сильному притяжению к ядру и более низкой энергии электрона? Как показывает рис. 21, электронное облако 3s-электрона в большей степени проникает в область, занятую электронами K- и L-слоев, и потому экранирует слабее, чем электронное облако 3p-электрона. Следовательно, электрон в состоянии 3sбудет сильнее притягиваться к ядру и обладать меньшей энергией, чем электрон в состоянии 3P. Электронное облако 3d-орбитали практически полностью находится вне области, занятой внутренними электронами, экранируется в наибольшей степени и наиболее слабо притягивается к ядру. Именно поэтому устойчивое состояние атома натрия соответствует размещению внешнего электрона на орбитали 3s.
Таким образом, в многоэлектронных атомах энергия электрона зависит не только от главного, но и от орбитального квантового числа. Главное квантовое число определяет здесь лишь некоторую энергетическую зону, в пределах которой точное значение энергии электрона определяется величиной l. В результате возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке (см. также рис. 22 на стр. 90):
1s<2s<2p <3s<3p 4s<3d<4p<5s<4d<5p<6s<4f ? 5d < 6p<7s<5f ? 6d < 7p
| <<< Назад 30. Магнитное и спиновое квантовые числа. |
Вперед >>> 32. Принцип Паули. Электронная структура атомов и периодическая система элементов. |
- 20. Радиоактивность.
- 21. Ядерная модель атома.
- 23. Квантовая теория света.
- 24. Строение электронной оболочки атома по Бору.
- 25. Исходные представления квантовой механики.
- 26. Волновая функция.
- 27. Энергетическое состояние электрона в атоме.
- 28. Главное квантовое число.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 30. Магнитное и спиновое квантовые числа.
- 31. Много электронные атомы.
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- 33. Размеры атомов и ионов.
- 34. Энергия ионизации и сродство к электрону.
- 35. Строение атомных ядер. Изотопы.
- 36. Радиоактивные элементы и их распад.
- 37. Искусственная радиоактивность. Ядерные реакции.
- Атомные реакторы и электронные кристаллы
- Микроэлектронные схемы
- Электронные носы
- Электронные сгустки
- Глава 19 Микроскопы, микроскопы…
- Глава 8 Геология рядом с нами
- «Живые кристаллы», открытые Стэнли
- Глава 2. Генетический детерминизм и генный селекционизм
- Как строятся сети
- Проверьте свои знания
- Как работать с учебником
- § 48 Строение атома и свойства химических элементов
