Книга: Общая химия
242. Химические свойства железа. Соединения железа.
| <<< Назад 241. Сплавы железа. |
Вперед >>> 243. Кобальт (Cobaltum). |
Разделы на этой странице:
242. Химические свойства железа. Соединения железа.
Чистое железо получают различными методами. Наибольшее значение имеют метод термического разложения пентакарбонила железа (см. § 193) и электролиз водных растворов его солей.
Во влажном воздухе железо быстро ржавеет, т. е. покрывается бурым налетом гидратированного оксида железа, который вследствие своей рыхлости не защищает железо от дальнейшего окисления. В воде железо интенсивно корродирует; при обильном доступе кислорода образуются гидратные формы оксида железа(III):
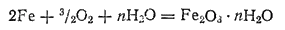
При недостатке кислорода или при его затрудненном доступе образуется смешанный оксид Fe3O4(FeO·Fe2O3):
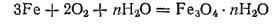
Железо растворяется в соляной кислоте любой концентрации:
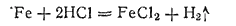
Аналогично происходит растворение в разбавленной серной кислоте:
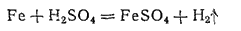
В концентрированных растворах серной кислоты железо окисляется до железа(III):
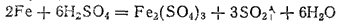
Однако в серной кислоте, концентрация которой близка к 100%, железо становится пассивным и взаимодействия практически не происходит.
В разбавленных и умеренно концентрированных растворах азотной кислоты железо растворяется:

При высоких концентрациях HNO3 растворение замедляется и железо становится пассивным.
Для железа характерны два ряда соединений: соединения железа(II) и соединения железа(III). Первые отвечают оксиду железа (II), или закиси железа, FeO, вторые — оксиду железа(III), или окиси железа, Fe2O3.
- 668 -
Кроме того, известны соли железной кислоты H2FeO4, в которой степень окисленности железа равна +6.
Соединения железа(II).
Соли железа(II) образуются при растворении железа в разбавленных кислотах, кроме азотной. Важнейшая из них — сульфат железа(II), или железный купорос, FeSO4·7H2O, образующий светло-зеленые кристаллы, хорошо растворимые в воде. На воздухе железный купорос постепенно выветривается и одновременно окисляется с поверхности, переходя в желто-бурую основную соль железа(III).
Сульфат железа(II) получают путем растворения обрезков стали в 20—30%-ной серной кислоте:
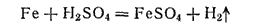
Сульфат железа(II) применяется для борьбы с вредителями растений, в производстве чернил и минеральных красок, при крашении тканей.
При нагревании железного купороса выделяется вода и получается белая масса безводной соли FeSO4 . При температурах выше 480°C безводная соль разлагается с выделением диоксида и триоксида серы; последний во влажном воздухе образует тяжелые белые пары серной кислоты:
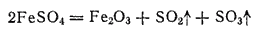
При взаимодействии раствора соли железа(II) со щелочью выпадает белый осадок гидроксида железа(II) Fe(OH)2, который на воздухе вследствие окисления быстро принимает зеленоватую, а затем бурую окраску, переходя в гидроксид железа (III)
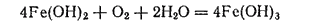
Безводный оксид железа(II) FeO можно получить в виде черного легко окисляющегося порошка восстановлением оксида железа(III) оксидом углерода(II) при 500°C:
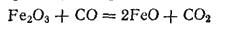
Карбонаты щелочных металлов осаждают из растворов солей железа(II) белый карбонат железа(II) FeCO3 . При действии воды, содержащей CO2 , карбонат железа, подобно карбонату кальция, частично переходит в более растворимую кислую соль Fe(HCO3)2. В виде этой соли железо содержится в природных железистых водах.
Соли железа (II) легко могут быть переведены в соли железа (III) действием различных окислителей — азотной кислоты, перманганата калия, хлора, например:
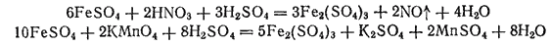
Ввиду способности легко окисляться, соли железа(II) часто применяются как восстановители.
- 669 -
Соединения железа (III).
Хлорид железа (III) FeCl3 представляет собой темно-коричневые с зеленоватым отливом кристаллы. Это вещество сильно гигроскопично; поглощая влагу из воздуха, оно превращается в кристаллогидраты, содержащие различное количество воды и расплывающиеся на воздухе. В таком состоянии хлорид железа (III) имеет буро-оранжевый цвет. В разбавленном растворе FeCl3 гидролизуется до основных солей. В парах хлорид железа (III) имеет структуру, аналогичную структуре хлорида алюминия (стр. 615) и отвечающую формуле Fe2Cl6; заметная диссоциация Fe2Cl6 на молекулы FeCl3 начинается при температурах около 500°C.
Хлорид железа (III) применяют в качестве коагулянта при очистке воды, как катализатор при синтезах органических веществ, в текстильной промышленности.
Сульфат железа (III) Fe2(SO4)3 — очень гигроскопичные, расплывающиеся на воздухе белые кристаллы. Образует кристаллогидрат Fe2(SO4)3·9H2O (желтые кристаллы). В водных растворах сульфат железа (III) сильно гидролизован. С сульфатами щелочных металлов и аммония он образует двойные соли — квасцы, например железоаммонийные квасцы (NH4)Fe(SO4)2·12H2O — хорошо растворимые в воде светло-фиолетовые кристаллы. При прокаливании выше 500°C сульфат железа (III) разлагается в соответствии с уравнением:
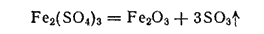
Сульфат железа (III) применяют, как и FeCl3, в качестве коагулянта при очистке воды, а также для травления металлов. Раствор Fe2(SO4)3 способен растворять Cu2S и CuS с образованием сульфата меди(II) это используется при гидрометаллургическом получении меди.
При действии щелочей на растворы солей железа (III) выпадает красно-бурый гидроксид железа (III) Fe(OH)3, нерастворимый в избытке щелочи.
Гидроксид железа (III) - более слабое основание, чем гидроксид железа (II) это выражается в том, что соли железа (III) сильно гидролизуются, а со слабыми кислотами (например, с угольной, сероводородной) Fe(OH)3 солей не образует. Гидролизом объясняется и цвет растворов солей железа (III): несмотря на то, что Fe3+ почти бесцветен, содержащие его растворы окрашены в желто-бурый цвет, что объясняется присутствием гидроксо-ионов железа или молекул Fe(OH)3, которые образуются благодаря гидролизу:
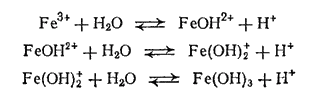
- 670 -
При нагревании окраска темнеет, а при прибавлении кислот становится более светлой вследствие подавления гидролиза.
При прокаливании гидроксид железа (III), теряя воду, переходит в оксид железа (III), или окись железа, Fe2O3. Оксид железа (III) встречается в природе в виде красного железняка и применяется как коричневая краска — железный сурик, или мумия.
Характерной реакцией, отличающей соли железа (III) от солей железа (II), служит действие роданида калия KSCN или роданида аммония NH4SCN на соли железа. Раствор роданида калия содержит бесцветные ионы SCN-, которые соединяются с ионами Fe(III), образуя кроваво-красный, слабо диссоциированный роданид железа(III) Fe(SCN)3. При взаимодействии же с роданидами ионов железа (II) раствор остается бесцветным.
Цианистые соединения железа. При действии на растворы солей железа (II) растворимых цианидов, например цианида калия, получается белый осадок цианида железа(II):
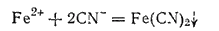
В избытке цианида калия осадок растворяется вследствие образования комплексной соли K4[Fe(CN)6] гексацианоферрата (II) калия
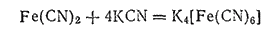
или
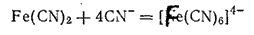
Гексацианоферрат(II) калия K4[Fe(CN)6]·3H2O кристаллизуется в виде больших светло-желтых призм. Эта соль называется также желтой кровяной солью. При растворении в воде соль диссоциирует на ионы калия и чрезвычайно устойчивые комплексные ионы [Fe(CN)6]4-. Практически такой раствор совершенно не содержит ионов Fe2+ и не дает реакций, характерных для железа(II).
Гексацианоферрат (II) калия служит чувствительным реактивом на ионы железа(III), так как ионы [Fe(CN)6]4-, взаимодействуя с ионами Fe3+, образуют нерастворимую в воде соль гексацианоферрат(II) железа (III) Fe4[Fe(CN)6]3 характерного синего цвета; эта соль получила название берлинской лазури:
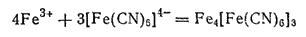
Берлинская лазурь применяется в качестве краски.
При действии хлора или брома на раствор желтой кровяной соли анион ее окисляется, превращаясь в [Fe(CN)6]3-
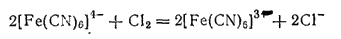
Соответствующая этому аниону соль K3[Fe(CN)6] называется гексацианоферратом(III) калия, или красной кровяной солью. Она образует красные безводные кристаллы.
- 671 -
Если подействовать гексацианоферратом(III) калия на раствор соли железа(II), то получается осадок гексацианоферрата (III), железа (И) (турнбулева синь), внешне очень похожий на берлинскую лазурь, но имеющий иной состав:
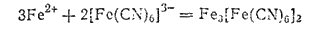
С солями железа (III) K3[Fe(CN)6] образует зеленовато-бурый раствор.
В большинстве других комплексных соединений, как и в рассмотренных цианоферратах, координационное число железа(II) и железа(III) равно шести.
Ферриты. При сплавлении оксида железа(III) с карбонатами натрия или калия образуются ферриты — соли не полученной в свободном состоянии железистой кислоты HFeO2, например феррит натрия NaFeO2:
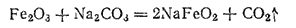
В технике ферритами или ферритными материалами называют продукты спекания порошков оксида железа(III) и оксидов некоторых двухвалентных металлов, например никеля, цинка, марганца. Спекание производится при 1000-1400°C. Ферриты обладают ценными магнитными свойствами и высоким электрическим сопротивлением, что обусловливает небольшую величину электрических потерь в них. Ферриты широко применяются в технике связи, счетно-решающих устройствах, в автоматике и телемеханике.
Соединения железа(VI).
Если нагревать стальные опилки или оксид железа(III) с нитратом и гидроксидом калия, то образуется сплав, содержащий феррат калия K2FeO4 — соль железной кислоты H2FeO4:
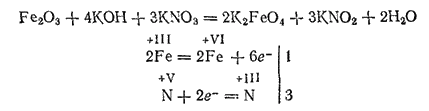
При растворении сплава в воде получается красно-фиолетовый раствор, из которого действием хлорида бария можно осадить нерастворимый в воде феррат бария BaFeO4.
Все ферраты — очень сильные окислители (более сильные, чем перманганаты). Соответствующая ферратам железная кислота H2FeO4 и ее ангидрид FeO3 в свободном состоянии не получены.
Карбонилы железа. Железо образует летучие соединения с оксидом углерода, называемые карбонилами железа. Пентакарбонил железа Fe(CO)5 представляет собой бледно-желтую жидкость, кипящую при 105°C, нерастворимую в воде, но растворимую во многих органических растворителях. Fe(CO)5 получают пропусканием СО над порошком железа при 150-200°C и давлении 10 МПа. Примеси, содержащиеся в железе, не вступают в реакции с СО, вследствие чего получается весьма чистый продукт. При нагревании в вакууме пентакарбонил железа разлагается на железо и СО; это используется для получения высокочистого порошкового железа — карбонильного железа (см. § 193).
Природа химических связей в молекуле Fe(CO)5 рассмотрена на стр. 430.
- 672 -
| <<< Назад 241. Сплавы железа. |
Вперед >>> 243. Кобальт (Cobaltum). |
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- Платиновые металлы 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- Органические соединения в космосе
- 119. Химические свойства галогенов.
- 118. Галогены в природе. Физические свойства галогенов.
- 185. Кремнийорганические соединения.
- Химические элементы и вещества
- § 50 Химические реакции
- § 58 Соединения, необходимые для существования жизни: белки, липиды
- § 56 Высокомолекулярные соединения
- § 57 Соединения, необходимые для существования жизни: нуклеиновые кислоты, полисахариды
- § 55 Циклические органические соединения
- 427. Какие химические элементы содержатся в морской воде в наибольших количествах?
- 910. Почему не следует сбрасывать в океан азотистые и фосфатные соединения, а также органические вещества?
