Книга: Общая химия
118. Галогены в природе. Физические свойства галогенов.
| <<< Назад Глава XII. ГАЛОГЕНЫ |
Вперед >>> 119. Химические свойства галогенов. |
118. Галогены в природе. Физические свойства галогенов.
Галогены, вследствие их большой химической активности, находятся в природе исключительно в связанном состоянии — главным образом в виде солей галогеноводородных кислот.
Фтор встречается в природе чаще всего в виде минерала плавикового шпата CaF2, получившего это название потому, что его прибавление к железным рудам приводит к образованию легкоплавких шлаков при выплавке чугуна. Фтор содержится также в минералах криолите Na3AlF6 и фторапатите Ca5F(PO4)3.
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl, который служит основным сырьем для получения других соединений хлора. Главная масса хлорида натрия находится в воде морей и океанов. Воды многих озер также содержат значительное количество NaCl — таковы, например, в СССР озера Эльтон и Баскунчак. Хлорид натрия встречается также и в твердом виде, образуя местами в земной коре мощные пласты так называемой каменной соли. В природе распространены и другие соединения хлора, например хлорид калия в виде минералов карналлита KCl·MgCl2·6H2O и сильвина KCl.
Хлор под давлением около 0,6 МПа уже при комнатной температуре превращается в жидкость. Сжиженный хлор обычно хранят и транспортируют в стальных баллонах или цистернах.
Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия и магния. Бромиды металлов содержатся в морской воде, в воде некоторых озер и в подземных рассолах. В нашей стране содержание брома в подземных буровых водах, имеющих промышленное значение, составляет от 170 до 700 мг/л.
Соединения иода также имеются в морской воде, но в столь малых количествах, что непосредственное выделение их из воды очень затруднительно. Однако существуют некоторые водоросли, которые накапливают иод в своих тканях. Зола этих водорослей служит сырьем для получения иода. Значительные количества иода (от 10 до 50 мг/л) содержатся в подземных буровых водах (от 10 до 50 мг/л) встречается также в виде солей калия — иодата KIO3 и перйодата KIO4, сопутствующих залежам нитрата натрия (селитры) в Чили и Боливии.
Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в пары фиолетового цвета, при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Самый тяжелый галоген — астат — в природе практически не встречается. Его получают путем искусственно осуществляемых ядерных реакций. Наиболее долгоживущий изотоп астата 210At имеет период полураспада всего 8,3 ч.
- 341 -
Ничтожные количества астата обнаружены в продуктах естественного радиоактивного распада урана и тория.
Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек. Более значительные количества галогенов могут вызвать тяжелое отравление.
Молекулы простых веществ, образуемых атомами галогенов, двухатомны. С увеличением в ряду F, Cl, Br, I, At радиуса атомов возрастает поляризуемость молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обусловливает возрастание температур плавления и кипения галогенов.
В ряду Cl2-Br2-I2 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Э2 на атомы (табл. 23), Причины этого заключаются в следующем. С увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается все дальше от атомных ядер. Поэтому при переходе от хлора к брому и иоду притяжение ядер атомов галогена к области перекрывания электронных облаков уменьшается. Кроме того, в ряду Cl—Br—I возрастает число промежуточных электронных слоев, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания.
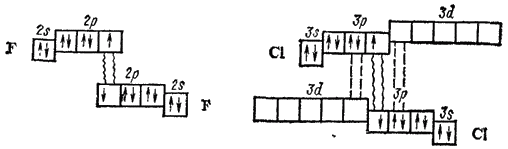
Уменьшение прочности связи в молекулах галогенов проявляется в падении их устойчивости к нагреванию: данные табл. 23 показывают, что при одной и той же температуре степень термической диссоциации молекул возрастает при переходе от Cl2 к Br2 и I2. Однако из этих же данных следует, что фтор выпадает из общей закономерности: прочность связи между атомами в его молекуле меньше, а степень термической диссоциации молекул выше, чем у хлора. Такие аномальные свойства фтора можно объяснить отсутствием d-подуровня во внешнем электронном слое его атома. В молекуле хлора и других галогенов есть свободные d-орбитали, и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь. Это показано на следующей схеме:
Галогены сравнительно мало растворимы в воде. Один объем воды растворяет при комнатной температуре около 2,5 объемов хлора.
- 342 -
Раствор этот называется хлорной водой. При пропускании хлора в охлажденную до 0°C воду из раствора выделяются зеленовато-желтые кристаллы клатратного соединения Cl2·8H2O. Растворимость брома при 20°C составляет около 3,5 г, а растворимость иода всего 0,02 г на 100 г воды.
Фтор не может быть растворен в воде, так как энергично разлагает ее:
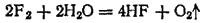
Значительно лучше, чем в воде, бром и иод растворяются в органических растворителях: сероуглероде, этиловом спирте, диэтиловом эфире, хлороформе, бензоле. Этим пользуются для извлечения брома и иода из водных растворов. Если, например, взболтать водный раствор иода с небольшим количеством сероуглерода (не смешивающегося с водой), то почти весь иод перейдет из воды в сероуглерод, окрашивая его в фиолетовый цвет.
| <<< Назад Глава XII. ГАЛОГЕНЫ |
Вперед >>> 119. Химические свойства галогенов. |
- § 17. Физические свойства и химический состав Земли
- Климат и общие физические условия экваториального пояса
- 4.2. Физические характеристики, строение ядра
- § 13. Явления природы. Физические явления
- Физические поля как один из видов материи.
- § 27 Физические поля
- Физические характеристики волны.
- Физические свойства морской воды
- 1.3. Физические условия формирования биосферы
- Таблица 4.4. Основные физические характеристики кометного ядра (минимальное, наиболее вероятное и максимальное значения)
- Астрофизические лаборатории для бедных
